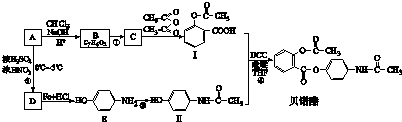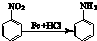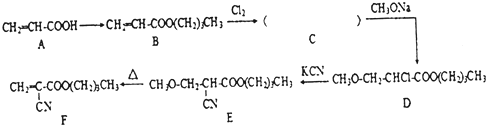
一定条件下发生反应:
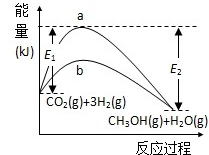
能量(kJ)反应过程CH3OH(g)+H2O(g)CO2(g)+3H2(g)baE2E1
CO
2(g)+3H
2(g)CH
3OH(g)+H
2O(g),如图表示该反应进行过程中的能量变化.
(1)图中曲线
(填“a”或“b”)表示使用催化剂时的反应进程.使用催化剂对该反应的影响是
(填选项字母).
A.提高反应速率
B.提高CO
2的转化率
C.降低反应活化能
D.改变反应的△H
(2)CO
2(g)+3H
2(g)CH
3OH(g)+H
2O(g)的化学平衡常数的表达式K=
.升高温度,K值将
(填“增大”、“减小”或“不变”).
(3)用含E
1、E
2的表达式表示
CO
2(g)+3H
2(g)CH
3OH(g)+H
2O(g)的△H=
kJ?mol
-1(4)一定温度下,在体积为2L的容积固定的密闭容器中,充入2molCO
2、6molH
2,经10min反应达到平衡状态W,生成1molCH
3OH.CO
2的转化率为
.从反应开始到平衡,用H
2的浓度变化表示的平均反应速率v(H
2)=
.该温度下,在体积为1L的容积固定的密闭容器中,从逆反应开始建立化学平衡,且各组分的平衡浓度与平衡状态W完全相同,则起始时充入容器的n(CH
3OH)=
,n(H
2O)=
.

 一定条件下发生反应:
一定条件下发生反应:

 某同学利用如图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,其操作可分解为如下几步:
某同学利用如图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,其操作可分解为如下几步: