
| A、甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 |
| B、石油和植物油都是混合物,且属于不同类的有机物 |
| C、乙醇转化为乙醛的反应有碳氧双键生成,属于消去反应 |
| D、纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、氨水中滴入酚酞溶液,溶液变红:NH3?H2O═NH4++OH- |
| B、90℃时,测得纯水中c(H+)?c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 |
| C、FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| D、向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-
| ||||
B、将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O
| ||||
| C、Fe2O3固体溶于过量氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | ||||
| D、苯酚钠溶液中通入少量的CO2:2C2H5O-+CO2+H2O→2C2H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验目的 | |
| A | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 证明SO2具有漂白性 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 证明氧化性:Cu2+>Fe3+ |
| D | 向Na2SiO3溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,Br2+H2?2HBr K=5.6×107 I2+H2?2HI K=43 |
非金属性:Br>I |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
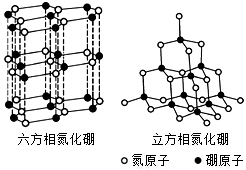 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
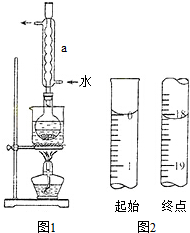 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
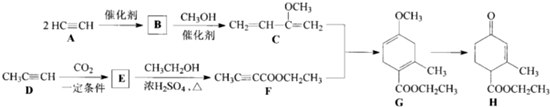
查看答案和解析>>
科目:高中化学 来源: 题型:
| 样品起始质量-a点固体质量 |
| 样品起始质量 |
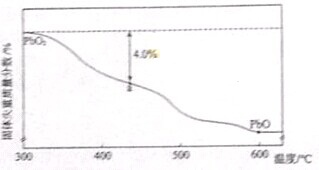
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com