
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:______;
(2)最外层电子数为次外层电子数![]() 的原子______或______;(填元素符号)
的原子______或______;(填元素符号)
(3)根据下列微粒回答问题:
![]() H、
H、![]() H、
H、![]() H、
H、![]() C、
C、![]() 、
、![]() 、
、![]() 、
、![]()
①以上8种微粒共有______种核素,共______种元素.
②互为同位素的是______.
③质量数相等的是______和______,中子数相等的是______和______.
【答案】![]() Li Si 6 5
Li Si 6 5 ![]() H、
H、![]() H、
H、![]()
![]()
![]()
![]()
![]()
【解析】
(1)根据质量数=质子数+中子数计算;
(2)最外层电子数最多为8,则次外层可能为2、8。
(3)①具有一定数目质子和一定数目中子的一种原子称为核素;
②同位素为质子数相等,而中子数不等的原子;
③根据质量数=质子数+中子数计算。
(1)质子数为8的原子,则为O,质量数=质子数+中子数=8+18=18,化学符号为![]() ;
;
(2)最外层电子数为次外层电子数![]() 的原子,若次外层为2,则最外层为1,即为Li;若次外层为8,则最外层为4,即为Si;若次外层为18,最外层为9,最外层最多为8,不符合实际,答案为Li或Si;
的原子,若次外层为2,则最外层为1,即为Li;若次外层为8,则最外层为4,即为Si;若次外层为18,最外层为9,最外层最多为8,不符合实际,答案为Li或Si;
(3)①具有一定数目质子和一定数目中子的一种原子称为核素,则共有6种核素;5种元素;
②同位素为质子数相等,而中子数不等的原子,则![]() H、
H、![]() H、
H、![]() 互为同位素;
互为同位素;
③质量数相等的是![]() C和
C和![]() ,中子数相等的是
,中子数相等的是![]() C和
C和![]() 。
。


科目:高中化学 来源: 题型:
【题目】结合元素周期表,回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图 1 中用实线补全元素周期表 的边界____________
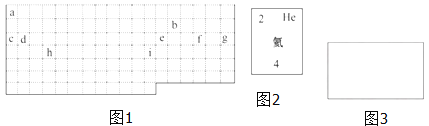
(2)表中所列元素,属于短周期元素的有____________;属于主族元素的有____________;g 元素位于第____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,请在如图 3 所示的方框中按 氦元素(图 2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子 质量_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题10分)
(1)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为______。
(2)某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48L,通入足量的溴水,溴水质量增加2.8g,此两种烃的组成为____(填分子式)。
(3)某烃是一种比水轻的油状液体,相对分子质量为78,碳元素与氢元素的质量比为12:1,不能使溴水和酸性高锰酸钾溶液褪色。写出此烃发生取代反应的化学方程式(任意写一个即可)___________。
(4)2.3g某有机物A完全燃烧后,生成0.1molCO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,已知此有机物可以与Na发生置换反应,写出此有机物与乙酸发生酯化反应的化学方程式______。
(5) 有机物的结构可用“键线式”表示,如:CH3-CH=CH-CH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,
。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,![]() ,苧烯的分子式为____。
,苧烯的分子式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原油价格的下跌,加剧能源的过度开采,因此更要开展汽油的有机合成的研究。以下是一种合成汽油的路线:
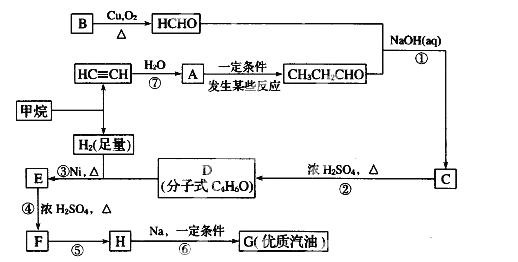
已知:R-CH2-CHO+R1-CH2-CHO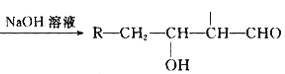
2R-CH2-Cl+2Na![]() R-CH2-CH2-R+2NaCl
R-CH2-CH2-R+2NaCl
CH3-CH=CH2+H-Cl
请根据以上信息回答下列问题:
(1)在反应①—⑥中,属于加成反应的是_________,B的分子式为 ________。
(2)A中官能团名称为_________, E的名称为 ____________。
(3)写出下列反应方程式:E→F_____________________H→G_________________。
(4)H也能与NaOH溶液反应,其反应方程式为:_________________________。
(5)D的核磁共振氢谱有____组吸收峰。写出符合下列条件D的所有同分异构体___________。
①链状结构,②能与钠反应生成气体,③不饱和碳上不与含氧官能团直接相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:

已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______;第②步分离采用的方法是______;第③步分离NaBH4并回收溶剂,采用的方法是_____;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
pH | 8 | 10 | 12 | 1 4 |
温度/℃ | 25 | 25 | 25 | 25 |
时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
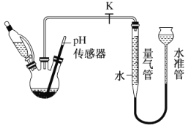
①实验中使用恒压滴液漏斗的原因为_________;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________(填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______mL·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿(PbS)与黄铁矿(FeS2)两矿法酸溶铅的示意图如下,下列说法错误的是( )
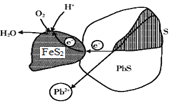
A.PbS上的电势比FeS2上的低
B.浸取液的pH随反应的进行逐渐增大
C.PbS表面发生的反应为PbS-2e-=Pb2++ S
D.FeS2表面发生的反应为FeS2+2e-=Fe2++ 2S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH→CH3COO+CH3CH2O+H2O
B. 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
D. 乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH![]() CH3COO+ Cu2O↓+3H2O
CH3COO+ Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,写出元素名称并画出原子结构示意图:
信息 | 元素名称 | 原子结构示意图 |
A元素原子核外M层电子数是L层电子数的一半 | ____ | ____ |
B元素原子最外层电子数是次外层电子数的1.5倍 | ____ | ____ |
C元素+1价离子C+的电子层排布与Ne相同 | ____ | ____ |
D元素原子次外层电子数是最外层电子数的 | ____ | ____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图 1,电池的工作原理如下图 2。下列有关说法正确的是
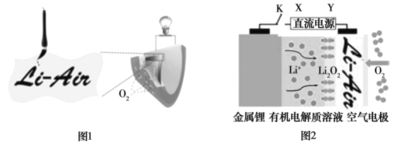
A.放电时,纸张中的石墨作锂电池的正极
B.开关 K 闭合给锂电池充电,金属锂电极上发生氧化反应
C.充电时,空气电极的反应式为: Li2O2 +2e- = 2Li+O2↑
D.电池工作时,电子的流向为:金属锂电极→有机电解质溶液→空气电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com