
两份质量相同的CH4和NH3相比较,下列结论错误的是
A.分子个数比为17:16 B.原子个数比为17:16
C.氢原子个数比为17:12 D.氢原子质量比为 17:12
B
【解析】
试题分析:质量相同的两种气体中含有的分子个数之比等于摩尔之比的反比,所以两份质量相同的CH4和NH3的分子数之比为17:16,故A正确;CH4和NH3的分子含有的原子数分别为5、4,由A知两份质量相同的CH4和NH3的分子数之比为17:16,所以含有的原子数之比为17×5:16×4=85:64,故B错误;CH4和NH3的分子含有的H原子数分别为4、3,由A知两份质量相同的CH4和NH3的分子数之比为17:16,所以含有的H原子数之比为17×4:16×3=17:12,故C正确;由C可知两份质量相同的CH4和NH3所以含有的H原子数之比为17:12,H原子数目之比等于H原子质量之比为17:12,故D正确.答案选B
考点:阿伏伽德罗定律


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:2014-2015学年湖南省高一上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列各组离子在水溶液中能大量共存的是 ( )
A.Na+、Ba2+、Cl?、SO42- B.Ca2+、HCO3?、Cl?、K+
C.Mg2+、Ag+、NO3?、Cl? D.H+ 、Cl? 、Na+ 、CO32?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
由X、Y两元素组成的气态化合物XY4,在一定条件下完全分解为A、B两种气体物质,己知标准状况下20mLXY4分解可产生标准状况下30mL A气体(化学式为Y2)和10mL B气体,则B的化学式为
A.X2 B.Y2X2 C.XY2 D.X2Y4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A. mol/L B.
mol/L B.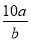 mol/L C.
mol/L C.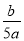 mol/L D.
mol/L D.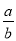 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
自来水中因含有少量Fe3+而不能用于溶液的配制,实验室为了除去自来水中的Fe3+获得纯净水,可采用的方法是
A.过滤法 B.结晶法 C.蒸馏法 D.沉淀法
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:填空题
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是 ;
要得出正确的实验结论,还需控制的实验条件是 。
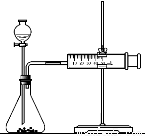
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验可选用的实验药品是 ;
应该测定的实验数据是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:选择题
在可逆反应2A+3B  xC+D中,A、B、C、D均为气态。已知:起始浓度A为5mol·L-1、B为3mol·L-1;C的反应速率为0.5mol·L-1·min-1;反应开始至达到平衡需2min,平衡时D的浓度为0.5mol·L-1, 下列关于此反应的说法中,不正确的是
xC+D中,A、B、C、D均为气态。已知:起始浓度A为5mol·L-1、B为3mol·L-1;C的反应速率为0.5mol·L-1·min-1;反应开始至达到平衡需2min,平衡时D的浓度为0.5mol·L-1, 下列关于此反应的说法中,不正确的是
A.平衡浓度A/B=5:3 B. x=2
C. B的平衡浓度为1.5mol·L-1 D.A的转化率为20%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省高二上学期半期考试化学试卷(解析版) 题型:选择题
在密闭容器中反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述不正确的是 ( )
A.平衡向逆反应方向移动 B. a+b>c+d
C.Z的体积分数减小 D. X的转化率下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com