
分析 (1)恒定T、V:若反应前、后气体体积不相等:换算为方程式同一边物质后,起始投料对应相等,为完全等效;
[1]为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=4mol来解答;
[2]为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=4mol来解答;
[3]依据极值转化为起始量,满足“等量等效”分析;
(2)恒定T、P时:恒温、恒压条件下:换算为方程式同一边物质后,起始投料符合同一比例,百分数W%(体积分数、物质的量分数或质量分数)一定相同,为不完全等效.
[1]为不完全等效平衡,按化学计量数转化到左边满足n(N2):n(H2)=1mol:4mol来解答;
[2]为不完全等效平衡,按化学计量数转化到左边满足n(N2):n(H2)=1mol:4mol来解答.
解答 解:(1)恒定T、V:
[1]为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=4mol,由N2(g)+3H2(g)?2NH3(g),则有:0+0.5Z=1;1+1.5Z=4;解得Z=2,
故答案为:2;
[2]为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=4mol,由N2(g)+3H2(g)?2NH3(g),则有:Y+1.5Z=4;由题Z=0.5解得Y=3.25;
故答案为:3.25;
[3]N2(g)+3H2(g)?2NH3(g)
起始量 1 4 0
起始量 X Y Z
转化量 X+0.5Z Y+1.5Z 0
XYZ满足关系为:X+0.5Z=1,Y+1.5Z=4;
故答案为:X+0.5Z=1;Y+1.5Z=4;
(2)恒定T、P时:
[1]按化学计量数转化到左边满足n(N2):n(H2)=1mol:4mol,2mol氨气按N2(g)+3H2(g)?2NH3(g)完全转化可以得到1mol氮气与3mol氢气,故(1+1):(Y+3)=1:4,解得Y=5,
故答案为:5;
[2]按化学计量数转化到左边满足n(N2):n(H2)=1mol:4mol,Zmol氨气按N2(g)+3H2(g)?2NH3(g)完全转化可以得到0.5Zmol氮气与1.5Zmol氢气,故(2+0.5Z):(10+1.5Z)=1:4,解得Z=4,
故答案为:4.
点评 本题考查化学平衡计算,涉及等效平衡问题,等效平衡的计算是难点、易错点,注意归纳理解等效平衡规律.


科目:高中化学 来源: 题型:解答题
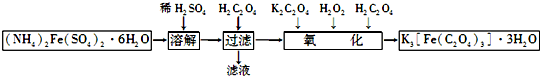
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中阴离子向正极移动 | |
| B. | 原电池是将电能转化为化学能的装置 | |
| C. | 原电池中电子流出的极为负极,发生氧化反应 | |
| D. | 原电池正极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
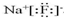 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键.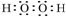 ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键. 或
或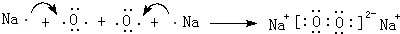 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com