
下列描述正确的是( )
A.在pH=1的溶液中,NH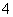 、K+、ClO-、Cl-可以大量共存
、K+、ClO-、Cl-可以大量共存
B.MgO可以除去MgCl2溶液中的FeCl3
C.足量铁粉与稀硝酸反应:Fe+4H++NO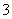 ===Fe3++2H2O+NO↑
===Fe3++2H2O+NO↑
D.向某溶液滴加盐酸酸化的氯化钡溶液,出现白色沉淀,则证明该溶液中含有SO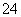
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
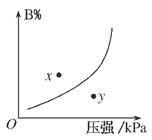
反应mA(s)+nB(g)⇌pC(g)ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p; ②x点表示的正反应速率大于逆反应速率;
③n>p; ④x点比y点时的反应速率慢;
⑤若升高温度,该反应的平衡常数增大。
A.①②⑤ B.只有②④ C.只有①③ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是1 mol NO2g)和1 mol COg)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________填“增大”、“减小”或“不变”,下同),ΔH________。
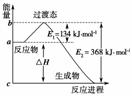
请写出NO2和CO反应的热化学方程式:
____________________________________________________。
2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OHg)+H2Og)===CO2g)+3H2g)
ΔH=+49.0 kJ·mol-1
②CH3OHg)+1/2O2g)===CO2g)+2H2g)
ΔH=-192.9 kJ·mol-1。
又知③H2Og)===H2Ol) ΔH=-44 kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
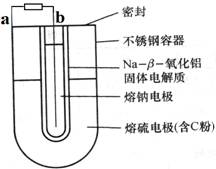
常用的电池是一个液体电解质将两个固体电极隔开。而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过。下列有关说法不正确的是
A.a为电池的正极
B.充电时b接电源的正极
C.正极反应为:nS8+16ne-=8Sn2-
D.Na+可以穿过固体电解质和硫反应从而传递电流
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: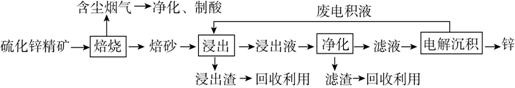
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____________________。
(2)浸出液“净化”过程中加入的主要物质为________,其作用是________。
(3)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(4)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为___________________________________________。
(5)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。” 该炼锌工艺过程主要反应的化学方程式为_________________________________________________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
Ⅱ.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
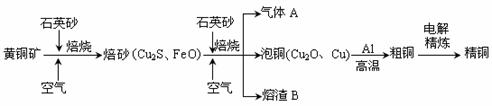
(6) 焙砂含Cu量为20%~50%。转炉中,将焙砂加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。焙砂中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、___________________________;
(7)假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol;
② 6 mol CuFeS2和14.25 mol O2反应,理论上可得到 molCu。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液的叙述正确的是( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液一定为中性
B.在Na2S溶液中:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO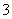 )
)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实与所得出的相应结论合理的是( )
| 选项 | 实验事实 | 结论 |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将燃着的镁条伸入盛有CO2的集气瓶中继续燃烧 | 还原性:Mg>C |
| C | SO2可以使酸性KMnO4溶液褪色 | SO2具有漂 白性 |
| D | 将铁粉放入稀HNO3中充分反应后,滴入KSCN溶液无明显现象 | 稀HNO3不能将Fe氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布式的原子中,半径最大的是
A ls22s22p63s23p5 B 1s22s22p3 C 1s22s22p2 D 1s22s22p63s23p2
查看答案和解析>>
科目:高中化学 来源: 题型:
为了配制NH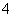 与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
①适量HCl ②适量NaCl ③适量氨水 ④适量NaOH
A.①② B.③ C.③④ D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com