
分析 ①符合材料是由两种或者两种以上材料组成;
②根据制备水泥和玻璃的原料分析;
③石英玻璃的主要成分为二氧化硅;
④对难降解的塑料垃圾(多指塑料袋)环境污染称为白色污染.
解答 解:①钢筋混凝土是钢筋和混凝土组成的常见的复合材料;
故答案为:不是;
②制备水泥的原料是粘土、石灰石;制备玻璃的原料是纯碱、石灰石、石英,所以都用到石灰石,
故答案为:石灰石;
③石英玻璃的主要成分为二氧化硅;
故答案为:二氧化硅;
④难降解的塑料垃圾(多指塑料袋)环境污染称为白色污染,用可降解的“玉米塑料”替代一次性饭盒、并可被用来制作世博会的证件及胸卡,可以防止产生白色污染;
故答案为:白色.
点评 本题考查了几种常见的材料,明确材料的成分及性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm=10-6m) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对太阳光进行光谱分析,可证明太阳上是否含有Ar元素 | |
| B. | 利用焰色反应鉴别NaCl和KCl两种溶液 | |
| C. | 利用石灰水鉴别纯碱和小苏打两种溶液 | |
| D. | 利用烧碱溶液鉴别MgCl2和AlCl3两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
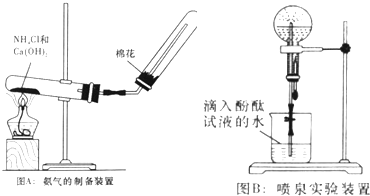
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
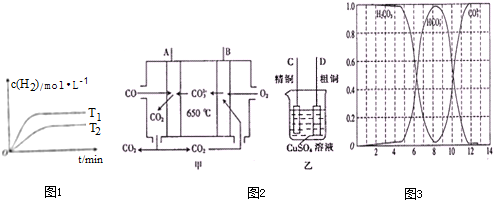
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
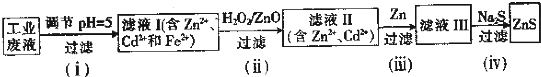
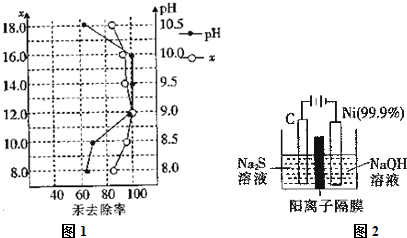
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 | |
| B. | 某微粒的结构示意简图为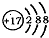 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | Be(OH)2的碱性比Mg(OH)2的碱性强 | |
| D. | 原子半径:Na>Si>O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com