
某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.100 mol·L-1稀盐酸和0.100 mol·L-1氢氧化钠溶液,
②取一粒药片(药片质量相同,均为0.100 g),研碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.100 mol·L-1氢氧化钠溶液滴定,用去体积为V时达到终点
④ 加入25.00 mL 0.100 mol·L-1稀盐酸。
加入25.00 mL 0.100 mol·L-1稀盐酸。
请回答下列问题
(1)测定过程的正确操作顺序为:________________(填序号)。
(2)测定过程中发生反应的离子方程式为:__________________、___________________。
(3)若某次实验需重复测定4次。实验室现有50 mL、100 mL、250 mL、500 mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为________________,理由是__________________。
(4)某同学四次测定的V数据如下:
测定次序 | 第一次 | 第 | 第三次 | 第四次 |
V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数________________。
(5)下列 实验操作会引起测量结果偏低的是 。
实验操作会引起测量结果偏低的是 。
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡②滴定前滴定管尖嘴有气泡,滴定后 尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水④滴定管用蒸馏水洗后,未用标准液洗⑤读取滴定管终点读数时,仰视刻度线。
尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水④滴定管用蒸馏水洗后,未用标准液洗⑤读取滴定管终点读数时,仰视刻度线。
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2017届河南省豫北推荐高三上学期精英对抗赛化学试卷(解析版) 题型:填空题
氮氧化物是目前造成大气污染的主要气体。NO在空气中存在如下反应:

(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变
△H2用含△H、△H1的式子来表示):
①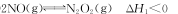
②________。
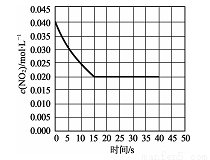
(2)在某温度下的一密闭容器中充人一定量的N02发生上述反应,测得NO2的浓度随时间的变化曲线如下图所示,前5秒内O2的平均生成速率为 mol.L-1.s-l,该条件下反应:2NO+O2 2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)
2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g) 2NO2 (g)△H (填“>”或“<”)0。
2NO2 (g)△H (填“>”或“<”)0。
(3)2NO(g)+O2(g) 2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)
2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g) 2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)
2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g) 2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
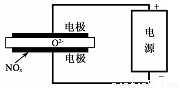
(5)电解法处理氮氧化物是目前大气污染治理的一个新思路。其原理是将NO.在电解池中分解成无污染的N2和02除去,如图所示,,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-。则电解池阴极的电极反应式为_____________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
下列反应能用H++OH-=H2O表示的是
A.氢氧化铜和稀盐酸 B.Ba(OH)2 溶液滴入稀硫酸中
C.澄清的石灰水和稀硝酸反应 D.醋酸和氢氧化钠反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
氨氮废水中 的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3?,两步反应的能量变化示意图如下:
的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3?,两步反应的能量变化示意图如下:
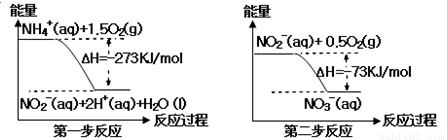
下列说法合理的是( )
A.该反应的催化剂是NO2?
B.升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3?
C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态
D.1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
把0.05 mol NaOH固体分别加入到下列100 mL溶液中,导电能力变化较大的是 ( )
A.0.5 mol·L-1 MgSO4溶液
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1的CH3COOH溶液
D.0.5 mol·L-1 NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学试卷(解析版) 题型:选择题
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是:
A.不是在室温下 B.弱酸溶液与强碱溶液反应
C.强酸溶液与强碱溶液反应 D.二元强酸溶液和一元强碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学试卷(解析版) 题型:选择题
一定温度下,在一恒容容器中进行的可逆反应A2(s)+3B2(g)  2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时消耗3mol B2
C.混合气体总的物质的量不变
D.容器内的气体密度不再改变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二文化学卷(解析版) 题型:选择题
聚丙烯酸酯类涂料是目前市场上流行的墙面涂料之一,它具有弹性好、不易老化、耐擦洗、色泽亮丽等优点.下边是聚丙烯酸酯的结构简式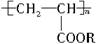 ,它属于( )
,它属于( )
①无机化合物 ②有机化合物 ③高分子化合物 ④离子化合物 ⑤共价化合物
A.①③④ B.①③⑤ C.②③⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上期中化学卷(解析版) 题型:填空题
现有下列四组物质:
A.CaO、MgO、CO2、CuO
B.H2、Cl2、N2、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
⑴填写下列表空白
A组 | B组 | C组 | D组 | |
分类标准 | ① | 非金 | ③ | 酸 |
不属于该类别的物质 | CO2 | ② | O2 | ④ |
① ;② ; ③ ;④ 。
⑵上表中四种物质相互作用可生成一种新物质—碱式碳酸铜[Cu2(OH)2CO3],该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com