
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2 L四氯化碳中含有的分子数0.5NA
B.常温常压下,18.0 g水所含的电子数为10 NA
C.300mL 0.1mol/L的NaCl的溶液含有0.03NA个NaCl分子
D.1.2 g熔融的NaHSO4含有阴阳离子总数为0.03NA
科目:高中化学 来源: 题型:
【题目】某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得滤液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水中一定含有的离子是_________________________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是______________________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-→ AlO2-+NH3+N2+H2O(未配平)。还原产物是_________,若除去0.2 mol NO3-,要消耗铝________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
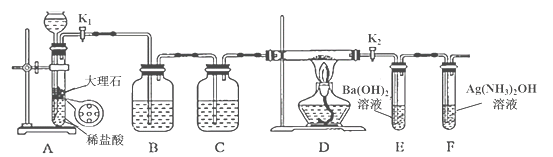
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如图所示。
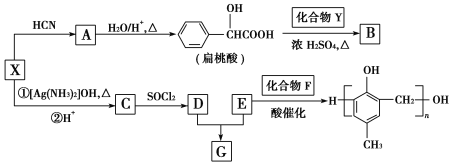
已知:①![]()
②![]() (R、R'代表烃基)
(R、R'代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y;
④化合物F的核磁共振氢谱图中只有一个吸收峰。
请回答下列问题:
(1)X的含氧官能团的名称是________________________,X与HCN反应生成A的反应类型是_______________________。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是__________________________。
(3)X发生银镜反应的化学方程式是:________________________。
(4)G在NaOH溶液中发生水解反应的化学方程式是_______________________。
(5)![]() 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。满足上述条件的同分异构体共有________种(不考虑立体异构)。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。满足上述条件的同分异构体共有________种(不考虑立体异构)。
(6)写出以C2H5OH为原料合成乳酸(![]() )的路线(其他试剂任选)。________________________________________________________________________。
)的路线(其他试剂任选)。________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用一定量铜片和50 mL浓度为2.0 mol/L的硝酸反应,当铜片完全溶解时收集到标准状况下280 mL的一氧化氮。请回答(忽略溶液体积变化):
(1)反应后溶液呈_______性(用“酸”、“碱”或“中”填空);
(2)反应后溶液中铜离子的物质的量浓度是多少_______(写出计算过程,保留三位有效数字)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁合金投入300mL ![]() 溶液中,金属恰好溶解,分别转化成
溶液中,金属恰好溶解,分别转化成![]() 和
和![]() ;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是( )
;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是( )
A.参加反应的![]() 的物质的量为0.9molB.NaOH的物质的量浓度为6
的物质的量为0.9molB.NaOH的物质的量浓度为6![]()
C.参加反应的金属的质量为11.9gD.![]() 的物质的量浓度为3
的物质的量浓度为3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制0.2mol/L的CuSO4溶液98mL,并探究硫酸铜的性质。实验室有两种不同的试剂可供选用:① CuSO4·5H2O晶体;②16%的CuSO4溶液 (ρ=2.3 g/mL)。回答下列问题:
(1)配制该硫酸铜溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外,还有________。
(2)若取用①来配置该硫酸铜溶液,需用托盘天平称量_______g;若取用②来配置,所选用硫酸铜溶液的体积为_______mL。
(3)若取用②来配置,下列操作会使得所配硫酸铜溶液浓度偏低的是____(填编号)。
a.量取硫酸铜溶液的量筒未用蒸馏水洗涤 b.容量瓶中有少量水
c.定容摇匀时,液面下降又加水 d.定容时仰视刻度线
(4)取所配硫酸铜溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。如何证明所取溶液中的硫酸根离子沉淀完全?________。
(5)课堂上,老师演示了金属钠与CuSO4溶液反应的实验,大家都观察到有蓝色沉淀生成,用化学反应方程式解释原因_________。个别较细心的同学还发现生成的蓝色沉淀中混有少量黑色难溶物,而所使用的药品均没有问题,该黑色难溶物是________(填化学式),猜测生成该黑色难溶物的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为 1∶2 的是 ( )
A.3S+6NaOH= 2Na2S+ Na2SO3+3H2O
B.2 CH3COOH+Ca(ClO)2=2HClO+Ca(CH3COO)2
C.I2+2NaClO3=2NaIO3+Cl2
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示(第一次平衡时c(I-)=2×10-3mol·L-1,c(Pb2+)=1×10-3mol·L-1),下列说法不正确的是

A.常温下,PbI2的Ksp=4×10-9
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度减小,Pb2+浓度不变
C.T时刻可能向溶液中加入了KI固体,Ksp不变
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com