
 二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下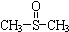 生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:
生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:分析 (1)根据盖斯定律来分析;
(2)根据反应方程式的特点以及平衡状态的本质时正逆反应速率相等来分析,注意反应中只有硫化氢为气体这一特点;
(3)根据平衡常数等于生成物的浓度幂之积与反应物的浓度幂之积的比值;
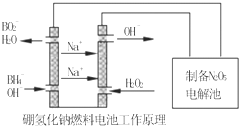
(4)逆向进行时,生成气体的物质的量增多,混乱度增大;根据钠离子移动方向,判断加入过氧化氢的一极为原电池的正极,发生还原反应.
解答 解:(1)利用盖斯定律,将②×2+③可得反应的热化学方程式为:2(CH3)2S(l)+O2(g)=2 (CH3)2SO(l)△H=-(2b+c)kJ•mol-1,
故答案为:2(CH3)2S(l)+O2(g)=2 (CH3)2SO(l)△H=-(2b+c)kJ•mol-1;
(2)A、无论反应是否达到平衡状态,都满足v(CH3OH)=2v(H2S),故A错误;
B、反应2CH3OH(l)+H2S(g)?(CH3)2S(l)+2H2O(l)中只有硫化氢为气体,当反应达到平衡时,硫化氢气体的物质的量不变,压强不变,故B正确;
C、只有硫化氢为气体,气体的质量和物质的量不变时则反应达到平衡,体积始终不变,当硫化氢气体的物质的量不变,气体的质量不变,则密度不变,故C正确;
D、只有硫化氢为气体,无论反应是否达到平衡状态,硫化氢的相对分子质量都不变,故D错误;
故答案为:BC;
(3)平衡常数是生成物的浓度幂之积与反应物的浓度幂之积的比值,据此可书写平衡常数的表达式应为$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$,故答案为:$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$;
(4)逆向进行时生成气体的物质的量增多,混乱度增大,即△S>0,在原电池中阳离子向正极移动,所以判断加入过氧化氢的一极为原电池的正极,正极上发生还原反应,过氧化氢得电子被还原,反应式为:H2O2+2e-=2OH-,故答案为:>;H2O2+2e-=2OH-.
点评 本题主要考查了盖斯定律的应用、平衡状态的判断以及电化学知识,注意知识的迁移应用是关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 6MgO+4Al$\frac{\underline{\;\;△\;\;}}{\;}$6Mg+2Al2O3 | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 4.0×10-38 | 2.0×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L的NaCl溶液 | B. | 150ml 3mol/LKCl溶液 | ||
| C. | 75ml 2mol/L的NH4Cl溶液 | D. | 50ml 1mol/lCuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
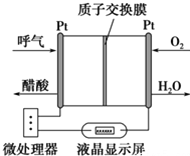 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| B. | 该电池的正极反应式为:O2+4e-+4H+═2H2O | |
| C. | 电流由O2所在的铂电极经外电路流向另一电极 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成1 mol AlN需转移3 mol电子 | |
| C. | AlN中氮元素的化合价为+3价 | |
| D. | AlN的摩尔质量为41 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +228.2 kJ•mol-1 | B. | -228.2 kJ•mol-1 | ||
| C. | +1 301.0 kJ•mol-1 | D. | +621.7 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com