
高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:
(1)已知:
②
锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为 (填化学式)。
(2)查阅相关资料:发生如下反应(反应未配平):

已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为
如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是 。
(3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。
写出该反应的离子方程式 。
(4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。

(14分,每空2分)(1)MnO2 (2)无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体)
(3)2MnO4-+5HC2O4+6H+=10CO2↑+2Mn2++8H2O
(4)Mn2+-2e-+2H2O=MnO2+4H+ Pb+PbO2+2H2SO4=2PbSO4+2H2O 2mol 87
【解析】
试题分析:(1)根据反应①②可知,在碱性溶液中MnO4-被还原生成物是MnO42-,在酸性溶液中MnO4-被还原生成物是Mn2+,即溶液的酸性越强,还原产物中Mn的化合价越低,所以在中性溶液中,MnO4-被还原生成物是MnO2。
(2)根据已知反应可知,XeO3能把Mn2+氧化生成MnO4-。又因为氯离子的还原性强于Mn2+的还原性,所以反应中还有氯气生成,因此可能观察到的现象是无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体)。
(3)草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去,这说明草酸具有还原性,能被酸性高锰酸钾溶液氧化生成CO2,所以反应的离子方程式是2MnO4-+5HC2O4+6H+=10CO2↑+2Mn2++8H2O。
(4)电解池中阳极失去电子,发生氧化反应,则Mn2+在阳极失去电子,发生氧化反应,因此阳极电极反应式是Mn2+-2e-+2H2O=MnO2+4H+。铅蓄电池中负极是Pb,正极是PbO2,所以铅蓄电池的总反应方程式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。所以根据方程式可知,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为2mol。根据电子得失守恒可知,阳极生成1mol MnO2,质量是87g。
考点:考查氧化还原反应的判断、方程式的书写、实验现象分析、以及电化学原理的应用和有关计算


科目:高中化学 来源: 题型:
(11分)实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置。
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是 (写编号);
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是 (写编号),写出微热时的反应方程式 ;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气。
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4 + 16HCl 2KCl + 2MnCl2 +5Cl2
+ 8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目。
②反应中 元素被氧化, 是氧化剂。当有1mol电子转移时,可生成气体 升(标准状态下)。
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示:
①写出圆底烧瓶中发生反应的化学方程式_
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是________,有关的化学方程式_________________________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市上海理工大学附属中学高一上期末考试化学试卷(带解析) 题型:实验题
实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置。
| 编号 | A | B | C |
| 发 生 装 置 | 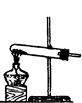 | 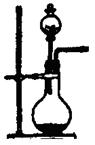 | 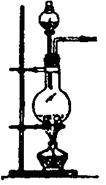 |
 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海理工大学附属中学高一上学期期末考试化学试卷 题型:实验题
(11分)实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置。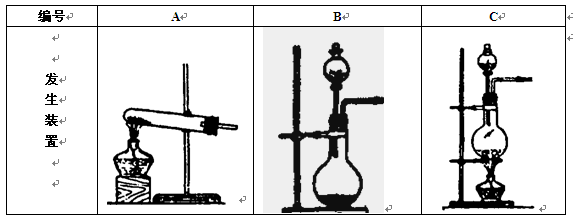
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是 (写编号);
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是 (写编号),写出微热时的反应方程式 ;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气。
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4 + 16HCl  2KCl + 2MnCl2 + 5Cl2
2KCl + 2MnCl2 + 5Cl2  + 8H2O
+ 8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目。
②反应中 元素被氧化, 是氧化剂。当有1mol电子转移时,可生成气体 升(标准状态下)。
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示: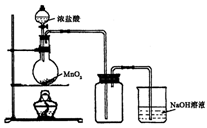
①写出圆底烧瓶中发生反应的化学方程式_
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是________,有关的化学方程式_________________________.
查看答案和解析>>
科目:高中化学 来源:2015届上海市高一上期末考试化学试卷(解析版) 题型:实验题
实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置。
|
编号 |
A |
B |
C |
|
发 生 装 置 |
|
|
|
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是 (写编号);
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是 (写编号),写出微热时的反应方程式 ;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气。
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 ↑ +
8H2O
2KCl + 2MnCl2 + 5Cl2 ↑ +
8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目。
②反应中 元素被氧化, 是氧化剂。当有1mol电子转移时,可生成气体 升(标准状态下)。
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示:

写出圆底烧瓶中发生反应的化学方程式_
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是________,有关的化学方程式_________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com