
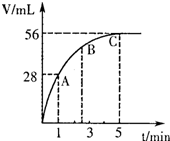
 ��50mL H2O2ˮ��Һ�м���2g�������̣��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ��
��50mL H2O2ˮ��Һ�м���2g�������̣��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ��| 0.056L |
| 22.4L/mol |
| n |
| V |
| 0.056L |
| 22.4L/mol |
| n |
| V |
| 0.005mol |
| 0.05L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
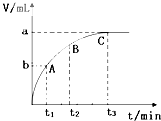
 Ϊ���о���������Թ�������ֽ����ʵ�Ӱ�죬ijͬѧ��������ʵ�飬��ش��������⣮
Ϊ���о���������Թ�������ֽ����ʵ�Ӱ�죬ijͬѧ��������ʵ�飬��ش��������⣮| ��� | �� �� | ʵ������ |
| �� | �ֱ����Թ�A��B�м��� 5mL 5% H2O2��Һ��������1��2 ��1mol/L FeCl3��Һ�����Թ��о����������ݳ���ʱ�����Թ�A����ʢ��5��������ˮ���ձ��У����Թ�B����ʢ��40��������ˮ���ձ��У� | �Թ�A�в��ٲ������ݣ��Թ�B�в��������������� |
| �� | ��ȡ��֧�Թֱܷ���� 5mL 5%H2O2��Һ�� 5mL 10%H2O2��Һ�� |
�Թ�A��B�о�δ�����ݲ��� |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| ��� | �� �� | ʵ������ |
| �� | �ֱ����Թ�A��B�м��� 5mL 5% H2O2��Һ��������1��2 ��1mol/L FeCl3��Һ�����Թ��о����������ݳ���ʱ�����Թ�A����ʢ��5��������ˮ���ձ��У����Թ�B����ʢ��40��������ˮ���ձ��У� | �Թ�A�в��ٲ������ݣ��Թ�B�в��������������� |
| �� | ��ȡ��֧�Թֱܷ���� 5mL 5%H2O2��Һ�� 5mL 10%H2O2��Һ�� |
�Թ�A��B�о�δ�����ݲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2006-2007ѧ��ɽ��ʡΫ���и�һ���£����л�ѧ�Ծ��������棩 ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com