
下图的实验装置用来分离CO2和CO气体并干燥。图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹分别接c、d两球胆,现装置内的空气已排尽。为使实验成功,甲、乙、丙中盛放的溶液分别是( )。

A.NaHCO3饱和溶液、12 mol·L-1盐酸、18.4 mol·L-1硫酸
B.Na2CO3饱和溶液、2 mol·L-1硫酸、NaOH饱和溶液
C.NaOH饱和溶液、2 mol·L-1硫酸、18.4 mol·L-1硫酸
D.18.4 mol·L-1硫酸、NaOH饱和溶液、18.4 mol·L-1硫酸
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
把22.4 g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是 ( )。
A.反应后生成的盐只为Fe(NO3)3
B.反应后生成的盐只为Fe(NO3)2
C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是( )
A.溶液的体积10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH :甲≤乙
查看答案和解析>>
科目:高中化学 来源: 题型:
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.电离能最小的电子能量最高
B.在离核最近区域内运动的电子能量最低
C.最易失去的电子能量最高
D.p轨道电子能量一定高于s轨道电子能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;③和⑦形成的一种常见溶剂的化学式为________,其立体构型为________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为________;该元素与元素①形成的最简单分子X属于________分子(填“极性”或“非极性”)。
(4)元素④的第一电离能________元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为________。
(6)元素⑩的基态原子核外电子排布式是________。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学想利用图示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
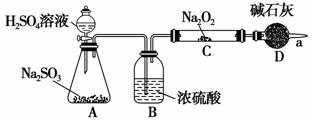
测得反应前C管的质量为m1 g,反应后C管的质量为m2 g,反应后装置D质量增加了n g。请分析:
Ⅰ.装置B的作用_________________________________________________;
装置D的作用_________________________________________________。
Ⅱ.如何检验反应中是否有O2生成______________________________________。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3,假设2:只有Na2SO4
假设3: ______________________________________________。
(1)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:将C中的固体配成溶液,加Ba(NO3)2溶液,得到白色沉淀,加足量稀硝酸,沉淀不溶解。得出结论:产物是Na2SO4。
该方案是否合理________(填“是”或“否”),理由是__________________________________________________________________
________________________________________________________________________。
(2)若假设1成立,某同学以反应前后C管的质量差(m2-m1)g为依据推断生成Na2SO3的质量为(m2-m1)×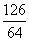 g。老师提示推算不合理,请你分析其中的缘由,________。
g。老师提示推算不合理,请你分析其中的缘由,________。
(3)若假设2成立,则参加反应的Na2O2的物质的量为________mol(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到预期的实验目的,下列操作正确的是( )
①配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度 ②用10 mL的量筒量取4.80 mL的浓硫酸 ③蒸发溶液时,边加热边搅拌,直至蒸发皿中的液体蒸干 ④向无色溶液中加入BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO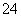 ⑤为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 ⑥中和热测定的实验中使用的玻璃仪器只有2种 ⑦实验室可利用浓氨水和碱石灰混合的方法制取少量氨气 ⑧除去NO中混有的NO2气体可通过水洗,再干燥后用向上排空气法收集
⑤为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 ⑥中和热测定的实验中使用的玻璃仪器只有2种 ⑦实验室可利用浓氨水和碱石灰混合的方法制取少量氨气 ⑧除去NO中混有的NO2气体可通过水洗,再干燥后用向上排空气法收集
A.③⑤⑧ B.④⑤⑥
C.①⑤⑦ D.①⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
吉林石化公司双苯厂发生的爆炸事故,使大量的苯胺及其生产原料(苯、硝基苯等)进入松花江,造成松花江水体被严重污染。
(1)下列有关叙述正确的是________(填序号)。
A.进入水体的苯会溶于水,造成鱼类大量中毒死亡
B.进入水体的硝基苯会浮在水面上迅速流向下游
C.工业上用硝基苯制取苯胺是氧化反应
D.苯和硝基苯的混合物可通过蒸馏的方法将其分离
(2)自来水厂对上述受污染的江水进行净化处理,采用的经济有效的方法是________(填序号)。
A.分液 B.过滤
C.用活性炭吸附有毒物质 D.加热蒸发
(3)磺胺类药物,常用于肠道抗菌感染的治疗,工业上可用苯为原料通过下列反应制得磺胺。(转化关系中—H2O、—HCl、—CH3COOH分别表示反应中有H2O、HCl、CH3COOH生成)
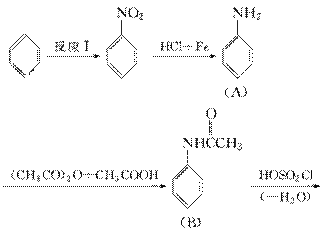
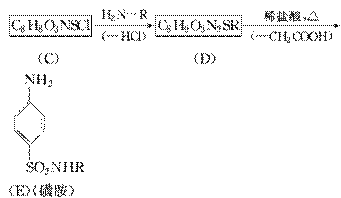
①反应Ⅰ的反应类型是________反应。
②分析上述反应过程中所提供的有关信息,写出C的结构简式:________________________________________________________________________。
③写出D→E的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向FeI2和FeBr2物质的量之比为1∶1的混合溶液中逐滴滴入氯水,下列离子反应不可能发生的是( )
A.2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
B.2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C.2Fe2++2I-+2Br-+3Cl2===2Fe3++I2+Br2+6Cl-
D.2Fe2++4I-+4Br-+5Cl2===2Fe3++2I2+2Br2+10Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com