
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到化学平衡状态 | |
| C. | 点d和点e处的n(N2)不相同 | |
| D. | 点e反应达到化学平衡状态,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 金属阳离子 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 化学式 | H2CO3 | HF |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=6.75×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
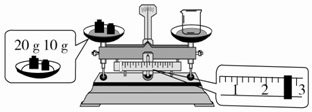
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 71:2 | B. | 35.5:108 | C. | 108:35.5 | D. | 71:109 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量不等、密度相等的N2和C2H4 | B. | 等体积等密度的CO和N2 | ||
| C. | 等温等体积的O2和N2 | D. | 等压等体积的N2和CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com