
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
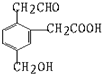 某有机物的结构式为它在一定条件下(如图)能发生的反应有( )
某有机物的结构式为它在一定条件下(如图)能发生的反应有( )| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
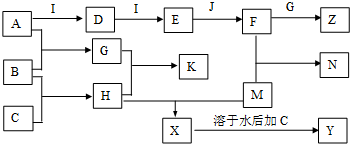
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律为我们提供了解决很难由实验直接测定而获得反应热的理论依据 | |
| B. | 若用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时只需要记录反应体系的最高温度t即可 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,再用环形玻璃搅拌棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
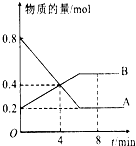 某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据
某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定某NaOH溶液的浓度,通常用已润洗的酸式滴定管放出25.00mL标准盐酸溶液于锥形瓶中,加2滴酚酞,然后向已润洗的碱式滴定管中注入未知浓度的NaOH溶液进行滴定 | |
| B. | 用无水CuSO4 、BaCl2溶液、稀盐酸、NaOH溶液、红色石蕊试纸、KSCN溶液、新制氯水等试剂可确定摩尔盐的化学式 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 萃取操作所用的分液漏斗使用前应加入少量水,见旋塞芯处是否漏水,待确认不漏水后则可以使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 20 | B. | 21 | C. | 22 | D. | 23 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com