
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
分析 a.求出金刚石的物质的量,然后根据1mol金刚石中含2mol碳碳键来分析;
b.一个氢氧化铝胶粒是多个氢氧化铝的聚集体;
c.Na2O2与水的反应为歧化反应;
d.溶液体积不明确;
e.1molSiO2晶体存在4molSi-O键;
f.求出 H2O2的物质的量,然后根据1mol双氧水中含18mol电子来分析;
g.SO2与O2的反应为可逆反应;
h. AlCl3的水解导致阳离子个数增多.
解答 解:a.12g金刚石的物质的量为1mol,而1mol金刚石中含2mol碳碳键,故含2NA条,故正确;
b.一个氢氧化铝胶粒是多个氢氧化铝的聚集体,故1mol明矾形成的胶粒的个数小于NA个,故错误;
c.Na2O2与水的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故正确;
d.溶液体积不明确,故溶液中氮原子的个数无法计算,故错误;
e.1molSiO2晶体存在4molSi-O键,所以30gSiO2晶体物质的量=$\frac{30g}{60g/mol}$=0.5mol,即0.5mol含有2molSi-O键,含有Si-O键的数目为2 NA ,故错误;
f.17g H2O2的物质的量为0.5mol,而1mol双氧水中含18mol电子,故0.5mol双氧水中含9mol电子即9NA个,故正确;
g.SO2与O2的反应为可逆反应,不能进行彻底,故转移的电子数小于4NA个,故错误;
h. AlCl3的水解导致阳离子个数增多,故溶液中的阳离子的个数大于0.1NA个,故正确.
故选A.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中W的最高价氧化物对应水化物的酸性最强 | |
| B. | 氢化物的热稳定性:HnY>HnW | |
| C. | Y和X、Z和X组成的常见化合物中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rW>rZ>rY>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率增大,化学平衡常数增大 | |
| B. | 减小压强,逆反应速率减小,化学平衡常数减小 | |
| C. | 加入催化剂,正逆反应速率不变,平衡不移动 | |
| D. | 充入氧气,正反应速率先增大后减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
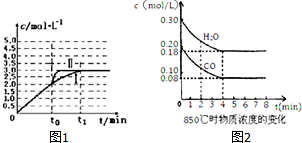
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
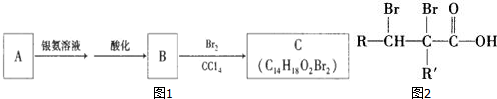
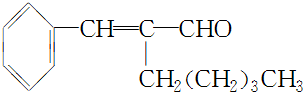 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$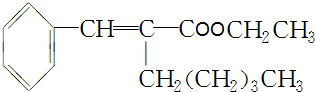 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 种 | B. | 6 种 | C. | 7 种 | D. | 8 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
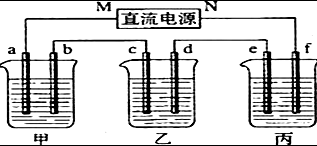 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com