
| 实 验 事 实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶不能保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
| ④ | 某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,向该溶液中滴加BaCl2溶液,有白色沉淀生成 | 确定该溶液中存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红 | 该溶液一定有NH4+ |
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | 全部 |
分析 ①二氧化硫具有还原性,能被强氧化剂氧化;
②二氧化硅和NaOH反应不属于氧化还原反应;
③亚硫酸钠在酸性条件下能被硝酸钡氧化生成硫酸钡;
④某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明阴离子是碳酸根离子或碳酸氢根离子;向该溶液中滴加BaCl2溶液,有白色沉淀生成,说明有碳酸根离子;
⑤该溶液也可能是氨水.
解答 解:①二氧化硫具有还原性,能被强氧化剂氧化,高锰酸钾溶液具有强氧化性,能和二氧化硫发生氧化还原反应而导致酸性高锰酸钾溶液褪色,该实验体现二氧化硫还原性,故错误;
②二氧化硅和NaOH反应不属于氧化还原反应,该反应中没有电子转移,故错误;
③亚硫酸钠在酸性条件下能被硝酸钡氧化生成硫酸钡,生成的不是亚硫酸钡,故错误;
④某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明阴离子是碳酸根离子或碳酸氢根离子;向该溶液中滴加BaCl2溶液,有白色沉淀生成,说明有碳酸根离子,所以该实验结论正确,故正确;
⑤生成的气体是氨气,但该溶液也可能是氨水,故错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断能力,明确实验原理、物质性质是解本题关键,注意二氧化硫漂白性和还原性区别,易错选项是⑤.


科目:高中化学 来源: 题型:选择题
| A. | 将lL2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| B. | 1L0.1mol/LNaHSO4溶液中含有0.1 Na个HSO4- | |
| C. | 常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | lmol铁与足量稀盐酸反应转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过质谱法只能确认化合物的相对分子质量,一般无法确定其结构 | |
| B. | 甲苯分子的核磁共振氢谱中有2个不同的吸收峰 | |
| C. | 红外光谱可以帮助确定许多有机物结构 | |
| D. | 某有机物完全燃烧只生成CO2和H2O,两者的物质的量之比为1:2,则该有机物可能为甲烷或甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数:N2<O2 | B. | 气体摩尔体积:N2<O2 | ||
| C. | 气体的压强:N2<O2 | D. | 体积:N2<O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
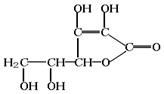
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
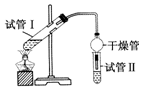 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<I2 | 氢化物沸点:HF<HCl<HBr<HI |
| B | 用电解熔融MgCl2可制得金属镁 | 用电解熔融NaCl也可以制取金属钠 |
| C | 将CO2通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al与S加热时直接化合生成Al2S3 | Fe与S加热时也能直接化合生成 Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com