
【题目】铬铁矿主要成分为FeO、Cr2O3,含有SiO2、Al2O3等杂质。工业上用铬铁矿制备红矾钠晶体(Na2Cr2O7)的流程如图所示:
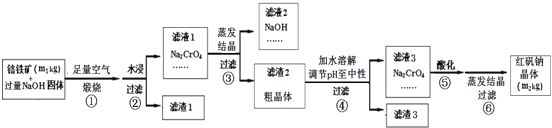
(1)步骤①的主要反应为FeO·Cr2O3+O2+NaOH![]() Na2CrO4+NaFeO2+H2O,该反应配平后FeO·Cr2O3与O2的系数比为___________。该步骤是在坩埚中进行煅烧,可用此坩埚材料的是______________(填标号)。
Na2CrO4+NaFeO2+H2O,该反应配平后FeO·Cr2O3与O2的系数比为___________。该步骤是在坩埚中进行煅烧,可用此坩埚材料的是______________(填标号)。
A.铁 B.氧化铝 C.石英 D.陶瓷
(2)步聚①煅烧反应极慢,需要升温至NaOH呈熔融状态,反应速率才加快,其原因是____________________________________________________。
(3)步骤②中NaFeO2会强烈水解生成氢氧化铁沉淀,反应的化学方程式为________________。
(4)将五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,保温过滤,所得实验数据如下表。根据数据分析,步骤③的最佳结晶温度为___________℃。
结晶温度/℃ | Na2CrO4粗晶中各物质含量/% | |||
Na2CrO4 4H2O | NaOH | NaAlO2 | Na2SiO3 | |
30 | 52.45 | 29.79 | 8.69 | 12.21 |
40 | 68.81 | 20. 49 | 8.46 | 10.84 |
50 | 60.26 | 27. 96 | 10.36 | 9.32 |
60 | 50.74 | 29.66 | 10.40 | 12.25 |
70 | 46.77 | 33.06 | 8.10 | 6.48 |
(5)步骤④中滤渣3的成分是_____________(写化学式)。
(6)若该流程中铬元素完全转化为红矾钠晶体,则该铬铁矿中铬元素的质量分数为____________(用含m1、m2的代数式表示)。
【答案】 4:7 A 熔融后增大了反应物的接触面积 NaFeO2+2H2O==Fe(OH)3↓+NaOH 40 AI(OH)3、H2SiO3(或H4SiO4) [52m2/131m1]×100%
【解析】试题(1)根据得失电子守恒计算FeO·Cr2O3与O2的系数比;步骤①在坩埚中进行煅烧的物质含有强碱氢氧化钠,氢氧化钠能和二氧化硅反应;(2)根据影响反应速率的因素分析;(3) NaFeO2强烈水解,生成氢氧化铁沉淀,根据质量守恒可知还应有NaOH;(4)根据五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,所得实验数据分析,步骤③的最佳结晶温度为40℃,此时Na2CrO4粗晶中得到的Na2CrO4![]() 4H2O含量最高;(5)步骤④为调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全沉淀,分离出Na2CrO4,据此分析解答;(6)依据铬元素质量守恒,计算该铬铁矿中铬元素的质量分数;
4H2O含量最高;(5)步骤④为调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全沉淀,分离出Na2CrO4,据此分析解答;(6)依据铬元素质量守恒,计算该铬铁矿中铬元素的质量分数;
解析:(1)1mol FeO·Cr2O3失电子7mol,1molO2得电子4mol,根据得失电子守恒,FeO·Cr2O3与O2的系数比为4:7;A.铁坩埚含有铁,铁与氢氧化钠不反应,故A正确;B.三氧化二铝能和氢氧化钠反应生成偏铝酸钠,故B错误; C.石英中含有二氧化硅,二氧化硅能和氢氧化钠反应,故C错误; D.陶瓷中含有二氧化硅,二氧化硅能和氢氧化钠反应,故D错误;故选A。(2) NaOH熔融后与FeO·Cr2O3接触面积增大,所以反应速率加快;(3) NaFeO2强烈水解,生成氢氧化铁沉淀,根据质量守恒可知还应有NaOH,反应方程式是NaFeO2+2H2O=Fe(OH)3↓+NaOH;(4)步骤③的目的:将滤液1在130℃蒸发1小时,冷却到结晶,比较所得实验数据,40℃,此时Na2CrO4粗晶中得到的Na2CrO4![]() 4H2O含量最高,所以步骤③的最佳结晶温度为40℃;(5)滤液1含有Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全转化为H2SiO3(或H4SiO4)沉淀,滤液为Na2CrO4,滤渣3的成分是Al(OH)3、H2SiO3;(6)最终得到m2kg红矾钠(Na2Cr2O7),含铬n(Cr)=
4H2O含量最高,所以步骤③的最佳结晶温度为40℃;(5)滤液1含有Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全转化为H2SiO3(或H4SiO4)沉淀,滤液为Na2CrO4,滤渣3的成分是Al(OH)3、H2SiO3;(6)最终得到m2kg红矾钠(Na2Cr2O7),含铬n(Cr)=![]() ,则该铬铁矿中铬元素的质量分数为:
,则该铬铁矿中铬元素的质量分数为: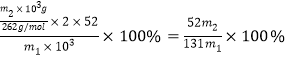 。
。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】为进行某些实验的探究,某兴趣小组设计了如下装置。

(1)为探究浓硫酸与木炭反应的全部产物,分液漏斗中盛浓硫酸,圆底烧瓶中放木炭。
①装置B中试剂的名称是________。
②装置C、D、E中所盛放的试剂分别是品红、酸性KMnO4溶液和澄清的石灰水。C装置的作用是________,确认产物中含有CO2的实验现象是________。
(2)为了制取无水氯化铜,上述装置中的分液漏斗中盛浓盐酸,圆底烧瓶中放MnO2,B中放铜粉并在玻璃管下添加酒精灯,且将B装置平移至D与E之间。
①此时C、D中依次加入的试剂分别是________。
②若E中为NaOH溶液用于尾气吸收,常温下发生反应的离子方程式为________。
③实验结束时,应首先熄灭装置B下面的酒精灯,其目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向KOH溶液中通入11.2L(已换算成标准状况下)氯气恰好完全反应生成二种含氯盐:0.7molKC1、0.2mnolKClO和X。则X是
A. 0.1molKClO3 B. 0.2molKClO3 C. 0.1molKClO4 D. 0.2molKClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨作为重要化工原料,被大量应用于工业生产。氨在不同催化剂条件下可发生下列两个反应:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=-1266.6kJ·molˉ1
2N2(g) +6H2O(g) △H=-1266.6kJ·molˉ1
(1)写出NO分解生成N2与O2的热化学方程式:___________________________。
(2)反应I在容积固定的密闭容器中进行,容器内部分物质的物质的量浓度如下表:
时间 浓度 | c(NH3)/mol/Ll | c((O2)/mol/L | c(NO)/ mol/L |
第 0 min | 0.8 | 1.6 | 0 |
第 2 min | 0.3 | 0.975 | 0.5 |
第 3 niin | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应从开始到第2min时,v(H2O)=__________________。
②在第3min时,改变的反应条件可能是_________(填选项字母)。
A.使用催化剂 B.臧小压强 C.升高温度 D.增加O2的浓度
③该反应达到平衡状态的标志是___________(填选项字母)。
A.在恒温恒容的容器中,混合气体的密度不再变化
B.单位时间内消耗nmolNO的同时消耗nmolNH3
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
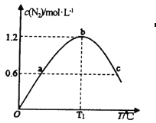
(3)①若在容积为2L的密闭容器中充入8molNH3(g)和6molO2(g),发生反应II。保持其他条件不变,在相同时间内测得c(N2)与温度的关系如图所示。则T1℃下,NH3的平衡转化率为___。
②图中a、c两点对应的容器内部压强Pa____Pc(填“>”、“<”或“=”)
(4)氨气可用于生成硝酸铵化肥。25℃时,已知NH3·H2O的电离常数Kb=1.8×10-5,则硝酸铵在此温度下发生水解反应的平衡常数Kh=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列反应并按要求填空。
(1)2Fe+3Cl2![]() 2FeCl3,氧化剂是___,还原剂是___;发生氧化反应的是____,发生还原反应的是_____。
2FeCl3,氧化剂是___,还原剂是___;发生氧化反应的是____,发生还原反应的是_____。
(2)2KMnO4![]() K2MnO4+MnO2+O2↑,氧化剂是____,还原剂是_____;被氧化的元素是_____,被还原的元素是__________。
K2MnO4+MnO2+O2↑,氧化剂是____,还原剂是_____;被氧化的元素是_____,被还原的元素是__________。
(3)2H2S+SO2=3S↓+2H2O,氧化剂是____________,还原剂是____________;发生氧化反应的是____,被还原的元素是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵可用作肥料,也可用于纺织、皮革、医药等方面。某化学兴趣小组对硫酸铵的一些性质进行探究。回答下列问题:
(1)在试管中加入少量硫酸铵样品,加水溶解,滴加NaOH溶液。将湿润的红色石蕊试纸放在试管口,试纸颜色无明显变化。再将试管加热,试纸很快变蓝。由此可知:______________________________________、_________________________________。
(2)从废铁屑中回收铁屑,用碱溶液洗净之后,再用过量硫酸溶解。然后加入稍过量硫酸铵饱和溶液。在小火下蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂。过滤后用少量乙醇洗涤,得到硫酸亚铁铵晶体。
①碱溶液洗涤的目的是__________________________________。
②硫酸过量的原因是___________________________________。
(3)硫酸铵高温下完全分解生成氨气和其他几种气体(含硫产物只有一种)。为探究硫酸铵的其他分解产物,通过下列装置进行实验,通入分解产物一段时间后,再点燃装置E中的酒精灯并开始用装置F收集气体。实验中观察到E中无明显现象,F中排水收集的气体能使燃着的木条熄灭,经测定其相对分子质量为28。
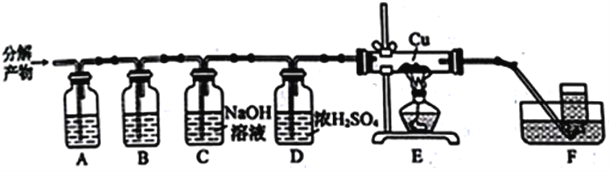
①装置A、B中的溶液分别是______(填标号)。B中可观察到的现象是_____________________。
a.NaOH溶液 b.硫酸溶液 c.BaCl2溶液 d.品红溶液
②装置E的作用是__________________________________。
③写出(NH4)2SO4高温分解的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液态。常温下,0.1mol·L-1丁溶液的pH为13。上述各物质间的转化关系如图所示。下列说法正确的是

A. 常温条件下元素A、B所形成化合物的状态一定是气态
B. 1.0 L 0.1mol·L-1戊溶液中阴离子的总物质的量小于0.1mol
C. 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子
D. 元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一次有机化学课堂小组讨论中,某同学设计了下列合成路线,你认为不可行的是( )
A. 用氯苯合成环己烯:![]()
B. 用甲苯合成苯甲醇:![]()
C. 用乙烯合成乙酸:![]()
D. 用乙烯合成乙二醇:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族;Y、Z同周期;X、Y、Z三种元素形成一种化合物M,25 ℃时,0.1 molL-1的M溶液中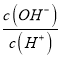 =1.0×10-12。下列说法正确的是
=1.0×10-12。下列说法正确的是
A. 简单离子半径:Y<Z<W
B. X分別与Z、W形成的化合物中,所含化学键类型相同
C. X、Y形成的最简单化合物的电子式为![]()
D. Z分別与X、W均可形成具有漂白性的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com