
【题目】下列实验操作中错误的是 ( )
A. 蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发。
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3。其中在一定条件下能与SiO2反应的有( )
A. ①②⑥ B. ②③⑥ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 3A(g)+2B(g)![]() xC(g)+2D(g)过程中的能量变化如下图所示,回答下列问题。
xC(g)+2D(g)过程中的能量变化如下图所示,回答下列问题。
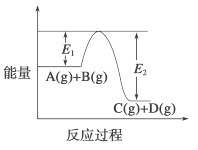
(1)当反应达到平衡时,升高温度,A 的转化率______(填“增大”“减小”或 “不变”),原因是______;
(2)反应体系中加入催化剂对反应热是否有影响?__________,若升高温度反应速率增大, E1的变化是: E1_________。(填“增大”“减小”或“不变”)。
(3)在一定条件下,将 2 mol A 和 2 mol B 混合于容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+ 2D(g)。2 min末反应达到平衡状态时,生成0.8 mol D,同时测得C的浓度为0.4 mol/L。则此时的平衡常数为________;如果增大体系的压强,则平衡体系中C的体积分数将______(填“增大”“减小”或“不 变”);如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各4/3mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______(填“A、B、C、D”)物质_______mol 。
xC(g)+ 2D(g)。2 min末反应达到平衡状态时,生成0.8 mol D,同时测得C的浓度为0.4 mol/L。则此时的平衡常数为________;如果增大体系的压强,则平衡体系中C的体积分数将______(填“增大”“减小”或“不 变”);如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各4/3mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______(填“A、B、C、D”)物质_______mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______;
![]()
(2) 原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为________________;
(3) Se原子序数为______,其核外M层电子的排布式为______;
(4) H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______,SO32-离子的立体构型为______;
(5) H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,
K2为1.2×10-2,请根据结构与性质的关系解释:
① H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________;
② H2SeO4比H2SeO3酸性强的原因: ______;
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
① H、C、N、O四种元素的电负性由小到大的顺序为_______________________。
② 与CNO-互为等电子体微粒的化学式为_________________(写出一种即可)。
③ 氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________________。
(7)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H―→Rx[CrCln(H2O)6-n]+xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 加热MgCl2·6H2O可得到无水MgCl2
B. 溶液中c(H+)>c(OH—),该溶液一定显酸性
C. 向水中加入加入盐也可能会抑制水的电离
D. Mg(HCO3)2溶液蒸干得到的固体物质是Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.丙烯分子中有8个σ键,1个π键
B.60g的SiO2晶体中,含有4mol共价键
C.NCl3和BCl3分子,都是三角锥形
D.SiH4的沸点高于CH4 , 可推测PH3的沸点高于NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法不合理的是( )
A. 从石油中得到汽油,可用蒸馏的方法
B. 提取溴水中的溴,可用加入乙醇萃取的方法
C. 只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯
D. 除FeCl2溶液中的少量FeCl3,可用加入足量铁屑过滤的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com