
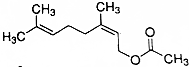
 某酯是一种食用香料,其结构简式如图所示,有关该酯叙述正确的是( )
某酯是一种食用香料,其结构简式如图所示,有关该酯叙述正确的是( )| A. | 分子式为C12H18O2 | |
| B. | 能发生加成反应、取代反应和消去反应 | |
| C. | 能使酸性KMn04溶液和溴水褪色,且褪色原理相同 | |
| D. | 1mol该有机物在一定条件下和H2反应,共消耗H2为2mol |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性强弱 | |
| B. | Na和AlCl3溶液反应 | |
| C. | 单质与H2O反应的难易程度 | |
| D. | 比较同浓度NaCl和AlCl3的pH大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
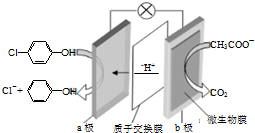 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( 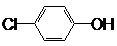 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | b为电池的正极,发生还原反应 | |
| B. | 电流从b极经导线、小灯泡流向a极+2e-+H+=Cl-+ | |
| C. | a极的电极反应式为: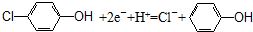 | |
| D. | 当外电路中有0.2mole-转移时,a极区增加的H+的个数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
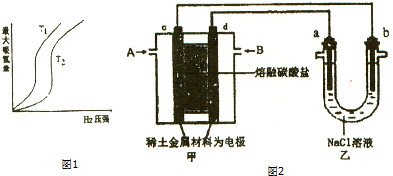
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯主要是从石油分馏中获得的一种重要化工原料 | |
| B. | 甲烷和苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 石油和煤均属于化石燃料,所含元素种类不相同 | |
| D. | C3H8有两种同分异构体,C5H12有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子的比例模型  | B. | 溴乙烷的电子式: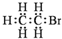 | ||
| C. | 2-氯丙烷的结构简式:CH3CHClCH3 | D. | 丙烯的键线式: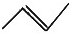 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
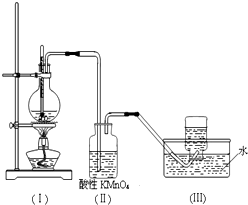 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com