
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.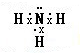 .
.分析 (1)氨气分子中氮原子和每个H原子之间都存在一对共用电子对;
(2)实验室用氯化铵和氢氧化钙加热制取氨气;氯化铵溶液显酸性是因为铵根离子的水解,在氯化铵溶液中由于铵根离子的水解,导致铵根离子浓度小于氯离子但远远大于氢离子和氢氧根离子的浓度;
(3)氨气溶于水生成一水合氨、一水合氨电离生成铵根离子和氢氧根离子,氨气、一水合氨和铵根离子之间都存在平衡关系,溶液中氢氧根离子浓度增大,抑制氨气溶解;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(5)燃料电池中,负极上燃料失电子发生氧化反应;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水.
解答 解:(1)氨气分子中氮原子和每个H原子之间都存在一对共用电子对,且N原子还有一个孤电子对,所以氨气电子式为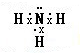 ,
,
故答案为: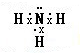 ;
;
(2)实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;产物为氯化铵,氯化铵溶液显酸性是因为铵根离子的水解,离子方程式为:NH4++H2O?NH3•H2O+H+;在氯化铵溶液中由于铵根离子的水解,导致铵根离子浓度小于氯离子但远远大于氢离子和氢氧根离子的浓度,离子浓度由大到小的顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;NH4++H2O?NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(3)NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出,
故答案为:NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应,反应方程式为2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,反应方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e-=N2+4H2O,故答案为:N2H4+4OH--4e-=N2+4H2O;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水,反应方程式为3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O,
故答案为:3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O.
点评 本题以氮的化合物为载体考查氧化还原反应、原电池原理等知识点,知道氨气的实验制法、化学平衡原理、原电池原理即可解答,难点是电极反应式书写,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净 | |
| B. | 上述变化过程中包括了分解、化合、复分解、置换等四种反应类型 | |
| C. | 步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解 | |
| D. | 步骤⑤也可以采用电解该盐水溶液的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 F.
F. 和CH2=CH-CH3G.
和CH2=CH-CH3G. 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 与
与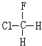 B.
B.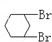 与
与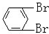 C.
C.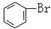 与
与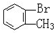 D.
D.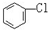 与
与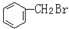 E.ClC(CH3)3与(CH3)2CHCH2Cl F.
E.ClC(CH3)3与(CH3)2CHCH2Cl F.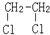 与CH3-CH2Cl.
与CH3-CH2Cl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①和③ | C. | ②和③ | D. | ①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表,一共18个纵行,而元素种类最多的族,在第3纵行 | |
| B. | 无论是吸热反应还是放热反应,升高温度,都能使反应速率加快 | |
| C. | 假设石墨转化为金刚石,需要吸收能量,则说明石墨比金刚石更稳定 | |
| D. | 非金属元素的非金属性越强,其氧化物对应的水化物酸性也一定越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式为CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式为CN-+H2O2+H2O═NH3↑+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com