
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是 ( )。
A.Na2SiO3 B.Na2CO3、Na2SiO3
C.Na2CO3、SiO2 D.SiO2
科目:高中化学 来源: 题型:
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法中正确的是 ( )。
A.从海水中提取溴时,不涉及氧化还原反应
B.苯与溴水反应生成溴苯
C.可以用CCl4萃取溴水中的溴
D.向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.03 mol Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变) ( )。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )。
A.往澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
B.往碳酸钠溶液中加入二氧化硅:CO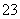 +SiO2===SiO
+SiO2===SiO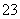 +CO2↑
+CO2↑
C.二氧化硅与烧碱溶液反应:SiO2+2OH-===SiO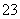 +H2↑
+H2↑
D.硅酸与烧碱溶液中和:H2SiO3+2OH-===SiO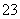 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
4NH3↑+SiH4↑+2MgCl2 (ΔH<0)

①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是____________________ _________________________________________________________。
 ③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________________,
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________________,
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是______________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________ _________________________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将11.9 g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下的体积为3.36 L。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀19.4 g,则上述反应中生成NO气体的体积为(标准状况下) ( )。
A.6.72 L B.11.2 L
C.22.4 L D.4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如下图所示:
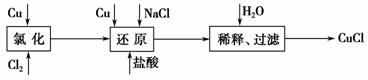
试回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是______________________________________________________________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式___________ ____________________________________________________________。
制备过程中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?
(已知Cu2++Cu+2Cl-===2CuCl)
___________________________________________________________。
(3)还原过程中加入少量盐酸的作用是________________________,加入过量NaCl的原因是___________________________________________________ ___________________________________________________。
(4)合成结束后所得产品用酒精淋洗的目的是___________________________ ___________________________________________________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式________________________________________ ______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应SiO2+3C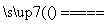 SiC+2CO↑的叙述中,正确的是 ( )。
SiC+2CO↑的叙述中,正确的是 ( )。
A.氧化剂是SiO2
B.氧化剂与还原剂的物质的量之比为1∶2
C.碳在反应中只作还原剂
D.若生成1 mol SiC,则转移电子2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com