
| ��ѧ�� | C-H | C-F | H-F | F-F |
| ����/��kJ•mol-1�� | 414 | 489 | 565 | 155 |
| A�� | ���� 1940 kJ | B�� | ���� 1940 kJ | C�� | ���� 485 kJ | D�� | ���� 485 kJ |
���� �Ȼ�ѧ����ʽ�У���Ӧ���ʱ��H=��Ӧ�������оɼ��������յ�����-�γ��µĻ�ѧ���ų����������ݴ˽�ϱ������ݼ��㣮
��� �⣺CH4��g��+4F2��g���TCF4��g��+4HF��g���ķ�Ӧ�ȡ�H=���ѻ�ѧ�����յ�����-�γɻ�ѧ���ų�������=414KJ/mol��4+155KJ/mol��4-��489KJ/mol��4+565KJ/mol��4��=-1940kJ•mol-1������ÿ���� 1mol CH4����1940 kJ��
��ѡA��
���� ���⿼�鷴Ӧ�����ʱ�ļ��㣬Ϊ�ÿ���Ƶ���㣬��Ŀ�ѶȲ���ע�ⷴӦ��Ӧ�����뷴Ӧ����ܼ��ܼ���������ܼ��ܣ�����������ѧ���ķ�����������ѧ����������


 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
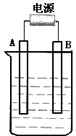 ��ͼ��ʾ����ʯī���缫�ĵ����У�����500mL��һ�����ʵ�ij��ɫ��Һ���е�⣬�۲쵽A�缫�����к�ɫ�����������ɣ�B�缫�л���ɫ�������ɣ���ʹ���۵⻯����Һ����������Һ�е�ԭ��������ȫ����ֹͣ��⣬ȡ��A�缫��ϴ�ӡ�����������缫����1.6g���ش��������⣮
��ͼ��ʾ����ʯī���缫�ĵ����У�����500mL��һ�����ʵ�ij��ɫ��Һ���е�⣬�۲쵽A�缫�����к�ɫ�����������ɣ�B�缫�л���ɫ�������ɣ���ʹ���۵⻯����Һ����������Һ�е�ԭ��������ȫ����ֹͣ��⣬ȡ��A�缫��ϴ�ӡ�����������缫����1.6g���ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֬���ʷ����������� | |
| B�� | ���·������������ۻ�Ϊͬ���칹�� | |
| C�� | ��ըʳ��Ļ����ͺ�ţ�Ͷ��ǿ������ı������� | |
| D�� | ĥ�����Ĵ��������ʣ�������к��ʱ���˰����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
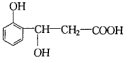 �ɷ�����Ӧ���͵�����ǣ�������
�ɷ�����Ӧ���͵�����ǣ�������| A�� | ֻ�Т٢ڢۢݢޢ� | B�� | ֻ�Тڢۢܢޢ� | C�� | ֻ�Т٢ڢۢݢ� | D�� | ֻ�Тۢܢݢޢߢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 0.1 L l mol•L-1 Na2CO3��Һ�У���������������0.1NA | |
| B�� | ��״���£�22.4 L�����к��е�ԭ����Ϊ2NA | |
| C�� | 100 g 98%��Ũ�����У���ԭ������Ϊ4NA | |
| D�� | 4.6 g���ΪC2H6O���л��C-H����Ŀ��һ��Ϊ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | t1��ʱ���������ʵ��ܽ�ȴ�С˳��Ϊ�������ң��� | |
| B�� | t2��ʱ���ס����������ʵ���Һ�����ʵ������������ | |
| C�� | ���������л��������������ʣ����ý��½ᾧ�ķ����ᴿ�� | |
| D�� | ��Ҫ�������N��ļ���Һת��ΪM��ļ���Һ�����Բ��ú��������ܼ��ķ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com