
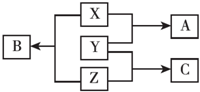
 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:分析 短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3,且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,据此解答,
(1)Y为氮元素是7号元素,位于周期表中第二周期VA族;
(2)X的单质为氧气与Z的单质为氢气,形成原电池反应负极上是氢气失电子发生氧化反应在碱溶液中生成水,正极是氧气得到电子生成氢氧根离子;
(3)X、Y、Z三种元素可组成一种强酸W为HNO3,C为NH3在适当条件下被W为HNO3溶液吸收生成一种盐为NH4NO3,溶液中铵根离子水解溶液显酸性;
(4)实验室制取C为氨气的化学方程式为氢氧化钙和氯化铵加热反应生成氯化钙、氨气和水.
解答 解:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3,且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,
(1)Y为氮元素是7号元素,位于周期表中第二周期VA族,故答案为:第二周期VA族;
(2)X的单质为氧气与Z的单质为氢气,形成原电池反应负极上是氢气失电子发生氧化反应在碱溶液中生成水,正极是氧气得到电子生成氢氧根离子,负极电极反应为H2+2OH--2e-=2H2O,
故答案为:氧气;H2+2OH--2e-=2H2O;
(3)X、Y、Z三种元素可组成一种强酸W为HNO3,C为NH3在适当条件下被W为HNO3溶液吸收生成一种盐为NH4NO3,溶液中铵根离子水解溶液显酸性,溶液PH<7,水解反应的离子方程式为:NH4++H2O?NH3•H2O+H+,溶液中所有离子浓度大小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:小于;NH4++H2O?NH3•H2O+H+;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)实验室制取C为氨气的化学方程式为氢氧化钙和氯化铵加热反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
点评 本题考查位置结构性质的关系、无机物推断等,推断该题的突破口为X、Y、Z三种短周期元素的单质为无色气体,再结合信息与转化关系推断,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:多选题

| A. | 吲哚不能使溴的四氯化碳溶液褪色 | |
| B. | 苯甲醛可发生加成、氧化和还原反应 | |
| C. | 可用银氨溶液鉴别苯甲醛和中间体 | |
| D. | 该中间体分子中含有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 4NH3+6NO$?_{△}^{催化剂}$5N2+6H2O | D. | NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 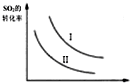 如图研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 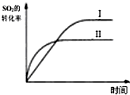 如图研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. |  图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 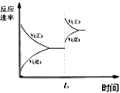 图中t0时增大压强,使平衡向负反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
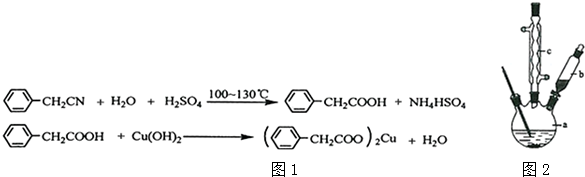
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
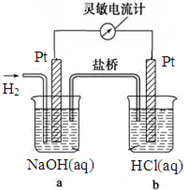 如图向a中通入H2,发现灵敏电流计指针发生偏转,持续通入H2可观察到b中铂电极表面有少量气泡产生,负极反应式为H2-2e-+2OH-=2H2O,电池的总反应为HCl+NaOH=H2O+NaCl.
如图向a中通入H2,发现灵敏电流计指针发生偏转,持续通入H2可观察到b中铂电极表面有少量气泡产生,负极反应式为H2-2e-+2OH-=2H2O,电池的总反应为HCl+NaOH=H2O+NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.
春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com