
| A. | 铁制品表面镀锌可以增强其抗腐蚀性 | |
| B. | 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 马口铁(镀锡)外层镀层被破坏后,里面的铁更易被腐蚀 | |
| D. | 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 |
分析 A.锌在空气中容易形成致密的氧化膜;
B.海轮外壳连接锌块,锌为负极;
C.原电池的负极更易被腐蚀,正极金属被保护;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极.
解答 解:A.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈,故A正确;
B.海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故B正确;
C.当马口铁(镀锡)破损后,形成的原电池中,金属铁是负极,易被腐蚀,故C正确;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极,所以钢闸门与电源的负极相连,故D错误.
故选D.
点评 本题考查学生金属的腐蚀和防护知识,注意原电池工作原理的应用是关键,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4L甲醇中含共价键数为5NA | |
| B. | 500ml 1mol/L醋酸溶液中含氧原子数为NA | |
| C. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| D. | 1 mol的羟基与1 moL的氢氧根离子所含电子数均为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
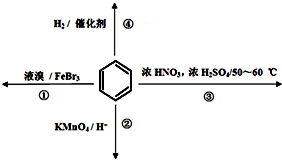
| A. | 反应①常温下不能进行 | |
| B. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| C. | 反应③为加成反应 | |
| D. | 反应④能发生,从而证明苯中是单双键交替结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若两烧杯中铝粉均已完全溶解,则两烧杯中放出氢气的量相同 | |
| B. | 若两烧杯中铝粉均未完全溶解,则盛氢氧化钠溶液的烧杯中放出氢气的量更多 | |
| C. | 若反应后,有一个烧杯中铝粉完全溶解,另一个烧杯中铝粉没有完全溶解,则那个还有铝没有溶解的烧杯原来盛着的是氢氧化钠溶液 | |
| D. | 无论如何,盐酸与铝粉反应产生的H2不可能比氢氧化钠溶液与铝粉反应产生的H2多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com