
【题目】海水中蕴藏着丰富的资源。除从海水中可制得食盐外,还可以制取镁、钾、溴及其化工产品。从海水中制取金属镁、溴的化工流程图如下:
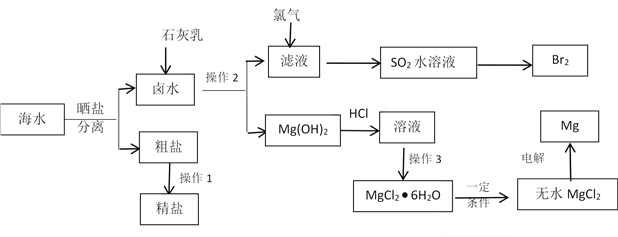
已知:MgO的熔点为28000C,MgCl2的熔点为7120C。
回答下列问题:
(1)操作2的方法是_____________,操作3具体指_____________________。
(2)操作1粗盐精制主要是要除掉粗盐中的Ca2+、Mg2+、SO42- 离子,以下试剂合理的组合是________
① 稀盐酸 ② NaOH ③ Na2CO3 ④ BaCl2
a.②③④① b.③②④① c.④②③① d.④③①②
(3)SO2水溶液可以起到富集溴的目的,该溶液吸收溴的离子反应方程式是____________ 。
(4)写出电解MgCl2制取Mg的化学方程式______________________。
(5)有同学认为:上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?_______(填“同意”或“不同意”),请说出你同意或不同意的理由____________________________。
【答案】 过滤 蒸发浓缩 降温结晶 c Br2 + SO2 + 2H2O ==== 2Br- + SO42- + 4H+ ![]() 不同意 MgO的熔点太高
不同意 MgO的熔点太高
【解析】(1)操作2是将固体和溶液分开,方法是过滤;从MgCl2溶液中获得MgCl2晶体,操作3具体指蒸发浓缩 降温结晶;(2)操作1粗盐精制主要是要除掉粗盐中的Ca2+、Mg2+、SO42- 离子,镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的次序为BaCl2、Na2CO3、NaOH、稀盐酸,故选C。(3)SO2水溶液可以起到富集溴的目的,溴将SO2氧化,该溶液吸收溴的离子反应方程式是 Br2 + SO2 + 2H2O= 2Br- + SO42- + 4H+;(4)电解MgCl2制取Mg的化学方程式![]() ;(5)不同意 ,MgO的熔点太高,,使其熔融所费能量太多,而MgCl2是离子晶体并且熔点低,熔融电解耗能少。
;(5)不同意 ,MgO的熔点太高,,使其熔融所费能量太多,而MgCl2是离子晶体并且熔点低,熔融电解耗能少。


科目:高中化学 来源: 题型:
【题目】3mol A和2.5 mol B混合于2L密闭容器中,发生的反应如下:3A(g)+B(g)![]() xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是
xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是
A. A的平均反应速率为0.1mol/(L·min)
B. 平衡时,B的转化率为20%
C. 平衡时,C的浓度为0.125 mol/L
D. 平衡时,容器内的压强为原来的0.875倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物 A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质:
① 在25℃时,电离常数K1=3.99×10-4,K2=5.5×10-6
②A+RCOOH(或ROH)![]() 有香味的产物
有香味的产物
③1molA![]() 慢慢产生l.5mol气体
慢慢产生l.5mol气体
④A在一定温度下的脱水产物(不是环状化合物)可和溴水发生加成反应
⑤A中有5种不同化学环境的氢
试回答:
(l)根据以上信息,对A的结构可作出的判断是__________(多选扣分)
(a)肯定有碳碳双键 (b)有两个羧基
(c)肯定有羟基 (d)有-COOR官能团
(2)有机物A的结构简式为_____________________________________________________
(3)A在一定温度下的脱水产物和溴水反应的化学方程式:_________________________________________________________
(4)A的一个同类别的同分异构体是(不含甲基)_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示:
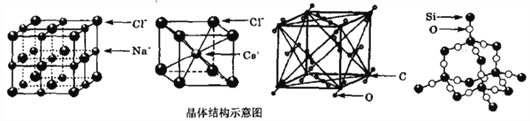
下列关于这些晶体结构和性质的叙述不正确的是( )
A. 在氯化钠晶体中每个Cl-周围同时吸引6个Na+,在氯化铯晶体中每个Cl-周围同时吸引8个Cs+
B. 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C. 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D. 在二氧化硅晶体中,硅原子与氧原子个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
②增大压强可加快SO2转化为SO3的速率
③黄绿色的氯水光照后颜色变浅
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
⑤对平衡体系H2(g)+I2(g) ![]() 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
A. ①③④ B. ②⑤ C. ①⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为( )
A. 32g B. 64 C. 64g·mol-1 D. 32 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学概念有关的说法或化学用语不正确的是( )
A. 用石墨作电极电解NH4Cl溶液的阳极反应式为:2Cl--2e-=Cl2↑
B. 由Al、Cu、浓硝酸组成的原电池,其正极反应式为:NO3-+2H++e-= NO2↑+H2O
C. 由Al、Mg、NaOH组成的原电池,其负极反应式为:Al-3e-+3OH- = Al(OH)3↓
D. Mg(OH)2固体在溶液中存在溶解平衡: Mg(OH)2(s) ![]() Mg2+(aq) + 2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq) + 2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色透明的各组离子中,在碱性溶液里能大量共存的是
A. K+、MnO4-、Cl-、SO42- B. Na+、SO42-、NO3-、Cl-
C. Na+、HCO3-、NO3-、SO42- D. Na+、K+、Cu2+、Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 工业上利用CO2生产甲醇燃料,反应方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。

①该反应在0-8 min内CO2的平均反应速率为_______。
②第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则v正_____v逆(填“>”、“<”或“=”)。
③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ改变的条件可能是______,曲线Ⅱ改变的条件可能是________。
④在一定温度下,在容积为2L的两个相同密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1molCO2、3molH2 | xmolCO2、ymolH2、zmolCH3OH(g)、zmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则z的取值范围为______。
(2)①将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_______性,该溶液中各离子浓度由大到小的顺序为:________________,所得溶液中c(H+)-c(OH-)=___________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
②采用下图装置将SO2转化为重要化工原料。若A为SO2,B为O2,则A为_____极,该极电极反应式为_______________。
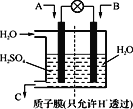
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com