
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | C. | $\frac{W}{161(W+18a)}$×100% | D. | $\frac{W}{161(W+36a)}$×100% |
分析 电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电生成氢气,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,根据质量分数公式计算即可.
解答 解:电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电生成氢气,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,
wg Na2SO4•10H2O硫酸钠的质量为:wg×$\frac{142}{322}$=$\frac{71w}{161}$g;
设电解水的质量为x,则:
2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,
36g 2mol
x amol
x=18ag,
所以饱和溶液的质量分数为:$\frac{\frac{71w}{161}}{w+18a}$×100%=$\frac{7100w}{161(w+18a)}$%,
故选C.
点评 本题以电解原理为载体考查了质量分数的计算,题目难度中等,明确电解后析出的硫酸钠晶体和电解的水组成的是饱和溶液是解本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| 实验操作 | 现象 | 结论 | |
| A | 在淀粉溶液中加入稀硫酸加热一段时间后冷却至室温,再加入碘水. | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 | 未出现银镜 | 水解的产物中没有葡萄糖 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀(Cu2O) | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
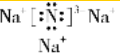 ,该化合物是离子化合物(选填“离子”、“共价”).
,该化合物是离子化合物(选填“离子”、“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
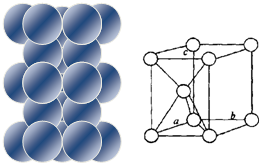 | (1)镁原子在二维空间的配位数为6 (2)位于晶胞中部的镁原子与离它最近两平面相切(填“相离”或“相切”或”相交”) |
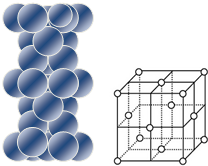 | (3)铜原子在三维空间的配位数为12 (4)请用含R2、NA的数学式子表达金属铜的密度:$\frac{8\sqrt{2}}{{N}_{A}•{{R}_{2}}^{3}}$g/cm3(根号带在分子上) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 硬度由大到小:金刚石>晶体硅>碳化硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
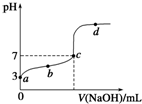 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )| A. | a点表示溶液中c(A-)为0.1 mol/L | |
| B. | a、b、c、d点表示的溶液中一定有:c(H+)•c(OH-)=1×10-14 | |
| C. | c点表示HA和NaOH恰好反应完全 | |
| D. | b、d点表示的溶液中,其$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$值一定不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com