
已知离子方程式:As2S3+H2O+NO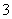 ―→AsO
―→AsO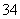 +SO
+SO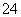 +NO↑+________
+NO↑+________  (未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
(未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
A.配平后水的化学计量数为4 B.反应后溶液呈酸性
C.配平后氧化剂与还原剂的物质的量之比为3∶28 D.氧化产物为AsO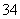 和SO
和SO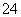
科目:高中化学 来源: 题型:
下列有关判断的依据不正确的是( )
A.氧化还原反应:是否有元素化合价的变化
B.吸热反应:是否要进行加热
C.化学平衡状态:平衡体系中各组分的质量分数不再改变
D.离子化合物:是否含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)⇌H2O(g)+CO(g)的平衡常数K= .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
|
| A. | 平衡时,乙中CO2的转化率大于60% |
|
| B. | 平衡时,甲中和丙中H2的转化率均是60% |
|
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L |
|
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:ClO-+Cl-+2H+=Cl2↑+H2O。下列说法正确的是( )
A.符合该离子方程式的化学方程式可以是:HClO+HCl= Cl2↑+H2O
B.标准状况下,每生成1.12L Cl2,转移0.05NA电子
C.在无色碱性溶液中,ClO-、Cl-、Al3+、Na+能大量共存
D.洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好、更安全
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的检验,其结论一定正确的是( )
A.某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他
现象,说明该溶液中一定含有SO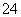
B.某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一
定含有 CO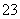 或 HCO
或 HCO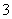
C.某溶液中加盐酸产生刺激性气味的无色气体,该气体能使品红溶液褪色,说明该溶
液中一定含有SO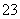
D.取少量久置的Na2SO3样品于试管中加水溶解,再加入足量盐酸有气体产生,然后加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH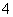 、Cl-、CO
、Cl-、CO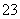 、SO
、SO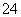 ,现分别取100 mL的两等份溶液进行如下实验:
,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)综合以上实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(2)写出②中产生沉淀的离子方程式 。
(3)某同学通过分析认为该溶液中K+一定 (填“存在”或“不存在”),他的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是
A.FeCl3溶液中加入过量的锌粉:Zn +2Fe3+=Zn2++2Fe2+
B.NH4Al(SO4)2中加入过量的NaOH溶液:Al3++4OH-=AlO2-+2H2O
C.(CH3COO)2Ba中加入稀硫酸:Ba2+ + SO42- = BaSO4↓
D.用惰性电极电解Cu(NO3)2溶液:2Cu2+ +2H2O  2Cu+ O2↑+ 4H+
2Cu+ O2↑+ 4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
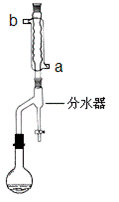
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10 mL的水洗涤。有机层继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥。
③将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集125~127 ℃的馏分,得11.6 g乙酸正丁酯
请回答有关问题。
(1)冷水应该从冷凝管 ___________(填a或b)管口通入。
(2)步骤①中不断从分水器下部分出生成的水的目的是_________________________
步骤①中判断反应终点的依据是_____________________________________。
(3)产品的精制过程步骤②中,第一次水洗的目的是_____________________________,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是_________________________________。
(4)下列关于分液漏斗的使用叙述正确的是____
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的2/3
C.萃取振荡操作应如右图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是_________________________
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有适 用范围,下列根据有关“规律”推出的结论正确的是
用范围,下列根据有关“规律”推出的结论正确的是
| 选项 | 规律 | 结论 |
| A | 较强 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com