
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化,2SO2(g)+O2(g)  2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
A.达到平衡时,SO2的浓度与SO3的浓度相等
B.相同状况下,反应2SO3(g)  2SO2(g)+O2(g)是一个吸热反应
2SO2(g)+O2(g)是一个吸热反应
C.为了提高SO2转化率,可适当提高O2浓度
D.升高温度,放热反应的速率增大,吸热反应的速率也增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高二化学试卷(解析版) 题型:选择题
新型弹性材料“丁苯吡橡胶”的结构简式如下:
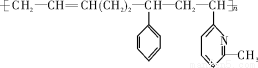 ?
?
其单体可能是下列6种的几种:
CH2CCH3CHCH2 ②CH2=CH—CH=CH2 ③C6H5CH=CH2
④CH3CHCHCH2 ⑤CH2=CHC5H3NCH3 ⑥CH2CHNCH3
正确的组合是
A.②③⑥ B.②③⑤ C.①②⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使淀粉-KI试纸显蓝色的溶液中:K+、SO42-、S2-、SO32-
B.含有0.1mol·L-1Fe2+的溶液:Na+、ClO-、SO42-、Cl-
C.c(H+)/c(OH-)=1012的溶液中:Al3+、NH4+、NO3-、K+
D.含有0.1mol·L-1HCO3-的溶液:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下列事实、离子方程式及其对应关系均正确的是.
A.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O
B.向K2Cr2O7溶液中滴加少量浓硫酸,溶液变为黄色: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
C.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH )2溶液等体积混合有白色沉淀生成:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
D.用铜电极电解饱和食盐水:2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:填空题
(6分)有下列七种物质:①Cl2 ②Na2O2 ③H2O2 ④NH4Cl ⑤CH4 ⑥NaHSO4 ⑦Ne
回答下列问题
(1)不存在化学键的是_______________;(填序号)
(2)含有极性键和非极性键的是_______________;(填序号)
(3)NaHSO4固体溶于水,破坏了_____________键;其电离方程式为______________________
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
应用元素周期表和元素周期律分析下列推断,其中正确的组合是
①根据元素周期律,由HClO4可类推出氟元素也存在HFO4
②在元素周期表的金属和非金属分界线附近寻找半导体材料
③铊(Tl)与铝同主族,原子核外有6个电子层,推测Tl(OH)3是两性氢氧化物
④碱金属单质和卤素单质的熔点都随原子序数的增大而增大
⑤砹(At)是VIIA族元素,其氢化物的稳定性大于HC1
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.②⑥ B.①③④ C.②③⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:简答题
(15分)
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
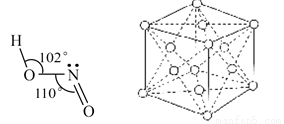
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个 键:
键:
HNO2的酸性比HN03弱是因为_____
(4)亚硝基钻钠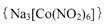 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
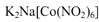 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。
①基态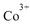 的价层电子排布图为_____
的价层电子排布图为_____
②用亚硝酸钻钠检验K+的离子方程式是
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则
A.反应过程中得到6.72L的气体(标准状况下)
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8g的沉淀
D.最终得到的溶液中c(NaCl)=1.6 mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>Ⅰ2 |
C | 左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 | 氧化性:Cl2>Br2>S |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com