
����Ŀ���п�Ժ������ѧ�����о�����һ�����³ɹ�ʵ���˼����Ч������ϩ�������ڴ����������⣬�������о����ɻ�ż����Ӧ������ϩ����ͼ��ʾ��

��1���ִ�ʯ�ͻ�������Ag����������ʵ����ϩ�������Ʊ�X������ʽC2H4O������˫�������÷�Ӧ�����������ԭ�Ӿ��ã���Ӧ�Ļ�ѧ����ʽ��______________���л�����д�ṹ��ʽ����
��2����֪������ʵ�ȼ�������ϱ���д�������Ʊ���ϩ���Ȼ�ѧ����ʽ_____________��
��3����400 ��ʱ�����ʼ���1 L�ĺ�ѹ��Ӧ���г���1 molCH4������������Ӧ�����ƽ����������C2H4���������Ϊ20.0%����
���ڸ��¶��£���ƽ�ⳣ��K��________��
�����������ͨ�����ˮ���������μӷ�Ӧ������400�棩��C2H4�IJ��ʽ�________��ѡ��������������С��������������ȷ��������������_____________��
������������̶�����ͬѹǿ�¿ɵñ仯����ͼ����ѹǿ�Ĺ�ϵ��__________��

��ʵ���Ʊ�C2H4ʱ��ͨ�����ڸ���Ӧ��2CH4(g) ��C2H6(g)��H2(g)����Ӧ����CH4��ʼ�����䣬��ͬ�¶���C2H6��C2H4������������¶ȵĹ�ϵ������ͼ��

A����200 ��ʱ����������������ϩ�����Ҫԭ�������_____________��
B��400��ʱ��C2H4��C2H6����������ֱ�Ϊ20.0%��6.0%������ϵ��CH4�����������_________��
���𰸡�2CH2 = CH2 + O2![]() 2
2 2CH4��g��
2CH4��g��![]() C2H4��g��+2H2��g����H=+202.0kJ/mol 0.20mol/L ���� �÷�ӦΪ���������������ȷ�Ӧ��ͨ�����ˮ�����൱�ڼ��ȣ�ͬʱͨ��ˮ��������������������൱�ڼ�Сѹǿ��ƽ������ƣ��������� p1��p2 ��200��ʱ��������������ʱ���ϩ�Ŀ� 28%
C2H4��g��+2H2��g����H=+202.0kJ/mol 0.20mol/L ���� �÷�ӦΪ���������������ȷ�Ӧ��ͨ�����ˮ�����൱�ڼ��ȣ�ͬʱͨ��ˮ��������������������൱�ڼ�Сѹǿ��ƽ������ƣ��������� p1��p2 ��200��ʱ��������������ʱ���ϩ�Ŀ� 28%
��������
(1)X�ķ���ʽC2H4O������˫�����жϳ�X�Ľṹ��ʽ����Ӧ�����������ԭ�Ӿ��ã��ݴ���д��Ӧ�Ļ�ѧ����ʽ��
(2)���ݱ�����������дH2��CH4��C2H4ȼ���ȵ��Ȼ�ѧ����ʽ��Ȼ����ݸ�˹���ɼ�������Ʊ���ϩ�ķ�Ӧ�ȣ�
(3)�ٸ�������ʽ���ƽ����������C2H4���������Ϊ20.0%���㣻
��ͨ�����ˮ�������൱�ڼ��Ⱥͼ�Сѹǿ������(2)�еķ�Ӧ�����ƽ���Ӱ�����ط������
������������̶������ݷ�Ӧ���������ѹǿ��ƽ���Ӱ������жϣ�
��A.����ͼ���Ϸ�Ӧ���ʽ��B.����������������ʵ���Ϊx�������ƽ��ʱC2H4��C2H6�����������ʵ������ټ����������������
(1)�ִ�ʯ�ͻ�������Ag����������ʵ����ϩ�������Ʊ�X(����ʽC2H4O������˫��)��XΪ ���÷�Ӧ�����������ԭ�Ӿ��ã���Ӧ�Ļ�ѧ����ʽΪ2CH2 = CH2 + O2
���÷�Ӧ�����������ԭ�Ӿ��ã���Ӧ�Ļ�ѧ����ʽΪ2CH2 = CH2 + O2![]() 2
2 ���ʴ�Ϊ��2CH2 = CH2 + O2
���ʴ�Ϊ��2CH2 = CH2 + O2![]() 2
2 ��
��
(2)���ݱ����������У���H2(g)+![]() O2(g)�TH2O(l)��H1=-285.8kJ/mol����CH4(g)+2O2(g)��CO2(g)+2H2O(l)��H2=-890.3kJ/mol����C2H4(g)+3O2(g)��2CO2(g)+2H2O(l)��H3=-1411.5kJ/mol�������Ʊ���ϩ�Ļ�ѧ����ʽΪ��2CH4(g)��C2H4(g)+2H2(g)�����ݸ�˹���ɣ�������2-��-����2�õ���2CH4(g)��C2H4(g)+2H2(g) ��H=2��H2-��H3-2��H1 =+202.5kJ/mol���ʴ�Ϊ��2CH4(g)��C2H4(g)+2H2(g)��H=+202.5 kJ/mol��
O2(g)�TH2O(l)��H1=-285.8kJ/mol����CH4(g)+2O2(g)��CO2(g)+2H2O(l)��H2=-890.3kJ/mol����C2H4(g)+3O2(g)��2CO2(g)+2H2O(l)��H3=-1411.5kJ/mol�������Ʊ���ϩ�Ļ�ѧ����ʽΪ��2CH4(g)��C2H4(g)+2H2(g)�����ݸ�˹���ɣ�������2-��-����2�õ���2CH4(g)��C2H4(g)+2H2(g) ��H=2��H2-��H3-2��H1 =+202.5kJ/mol���ʴ�Ϊ��2CH4(g)��C2H4(g)+2H2(g)��H=+202.5 kJ/mol��
(3)��400��ʱ����1L�ĺ��ݷ�Ӧ���г���1mol CH4������������Ӧ�����ƽ����������C2H4���������Ϊ20.0%��
2CH4(g)C2H4(g)+2H2(g)
��ʼ(mol) 1 0 0
ת��(mol) 2x x 2x
ƽ��(mol) 1-2x x 2x
������![]() ��20.0%����ã�x=0.25��ƽ�����������=
��20.0%����ã�x=0.25��ƽ�����������=![]() ��1L=1.25L�����Ի�ѧƽ�ⳣ��ΪK=
��1L=1.25L�����Ի�ѧƽ�ⳣ��ΪK=![]() =
=  =0.20mol/L���ʴ�Ϊ��0.20mol/L��
=0.20mol/L���ʴ�Ϊ��0.20mol/L��
��2CH4(g)��C2H4(g)+2H2(g)��H=+202.5 kJ/mol����ӦΪ���������������ȷ�Ӧ��ͨ�����ˮ����(���μӷ�Ӧ������400��)�൱�ڼ��ȣ�ƽ�����ƣ���������ͬʱͨ��ˮ��������������������൱�ڼ�Сѹǿ��ƽ�����ƣ�����Ҳ�������C2H4�IJ��ʽ����ʴ�Ϊ�����÷�ӦΪ���������������ȷ�Ӧ��ͨ�����ˮ�����൱�ڼ��ȣ�ͬʱͨ��ˮ��������������������൱�ڼ�Сѹǿ��ƽ������ƣ���������
������������̶���2CH4(g)��C2H4(g)+2H2(g)����ӦΪ�������������ķ�Ӧ���¶���ͬʱ��ѹǿ�������ڷ�Ӧ������У�CH4��ƽ��ת���ʽ��ͣ����p1��p2���ʴ�Ϊ��p1��p2��
��A.����ͼ��200��ʱ����������������ϩ�࣬����Ϊ��������ķ�Ӧ���ʽϿ죬�ʴ�Ϊ����200��ʱ��������������ʱ���ϩ�Ŀ죻
B.����������������ʵ���Ϊx����C2H4Ϊ0.2x��C2H6Ϊ0.06x������2CH4(g)��C2H4(g)+2H2(g)��2CH4(g) ��C2H6(g)��H2(g)��֪�����ɵ�����Ϊ0.4x+0.06x=0.46x�����еļ���Ϊx-(0.2x+0.06x+0.46x)=0.28x�������ϵ��CH4���������=![]() ��100%=28%���ʴ�Ϊ��28%��
��100%=28%���ʴ�Ϊ��28%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧҪ�ڰ������������������ʣ�ʹ�������ʼ��ܷ�����Ӧ�����������ʼ䲻�ܷ�����Ӧ������Ϊ�������������п�ȱ��һ��Ӧ�����������(����)

A. ���� B. ���� C. ������̼ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������˵����ȷ����
A. 1. 0mol��L-1 AlCl3����Һ�к�Al3+����ĿС��0. 1NA
B. 0. 5mol�������к��Ǽ��Լ�����ĿΪ2. 5NA
C. 30g�������Ǻ�����(C3H6O3)��ɵĻ�����к���ԭ����ĿΪ2NA
D. 7. 1g Cl2��ȫ��Ӧת�Ƶĵ�����һ��Ϊ0. 2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ����
A. ��״���£�22.4 L C2H6O���е�O-H����ĿΪNA
B. 100 g ��������17%H2O2��Һ�м��Լ���ĿΪNA
C. 65 g Zn������Ũ�����ַ�Ӧ�û������ķ�����ΪNA
D. 1 L 0.1 mol/L K2Cr2O7��Һ�к�������������Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��ZΪ���ֶ���������Ԫ����ֻ��һ���ǽ���Ԫ�ء�������Ԫ�����ڱ��е����λ������ͼ��ʾ������˵����ȷ����

A. X��Y��Z��Y��������������������
B. W���⻯����н�ǿ�Ļ�ԭ��
C. Ԫ��Y��Z����Ȼ���о���������̬
D. �⻯��ķе�Xһ��С��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 1L0.1mol/L�� NaHSO4��Һ����������ԭ����ĿΪ0.4NA
B. 1mol��OH(�ǻ�)��1 mol H3O+�������ĵ�������Ϊ10NA
C. 7.1gCl2������Fe��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.2NA
D. 80gCuO��Cu2S�Ļ�����У�����ͭԭ����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ���ݻ�Ϊ2 L ���ܱ������У�X��Y��Z������������ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ���д���пհף�
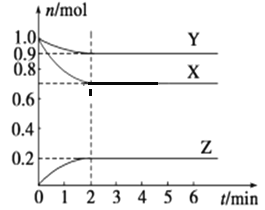
��1���÷�Ӧ�Ļ�ѧ����ʽΪ��______________________��
��2����Ӧ��ʼ��2 min������Z��ƽ����Ӧ����v��Z��=____________��
��3��1minʱ�����淴Ӧ���ʵĴ�С��ϵΪ��v��____________v�����>������<����=������4minʱ��v��____________v����ͬǰ������X��Y��Z��Ϊ���壬��Ӧ�ﵽƽ��ʱ������ʱ�������������СΪԭ����1/2�����ﵽƽ��ʱ���������¶Ƚ�����(���������������Ƚ���)����÷�Ӧ������ӦΪ________��Ӧ(��������������������)��
��4��������Ӧ��t1��t6�ڷ�Ӧ������ʱ��ͼ����ͼ����ÿһʱ�̾��ı�һ��Ӱ�췴Ӧ���ʵ����أ�������˵����ȷ����____________��

A����t1ʱ������ѹǿ
B����t3ʱ�����˴���
C����t4ʱ�������¶�
D��t2��t3ʱX��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2��O2![]() 2SO3�ǹ�ҵ�������һ����Ҫ��Ӧ������˵����ȷ����
2SO3�ǹ�ҵ�������һ����Ҫ��Ӧ������˵����ȷ����
A. ʹ�ô����ܸı�÷�Ӧ��
B. ��СSO2��Ũ���ܼӿ�÷�Ӧ������
C. ������ϵ�¶��ܼӿ췴Ӧ����
D. 1 mol SO2��������O2��һ�������³�ַ�Ӧ������1 mol SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����Ӧ��Fe(s)+CO2(g) ![]() FeO(s)+CO(g)��H1��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g)
FeO(s)+CO(g)��H1��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g) ![]() FeO(s)+H2(g)��H2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶�ʱK1��K2��ֵ���±���
FeO(s)+H2(g)��H2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶�ʱK1��K2��ֵ���±���

��Ӧ CO2(g) + H2(g) ![]() CO(g) + H2O(g) ��H��ƽ�ⳣ��K�����H=_____________________(�á�H1�͡�H2��ʾ)��K=____________________________________(��K1��K2��ʾ)���������������֪����ӦCO2(g) + H2(g)
CO(g) + H2O(g) ��H��ƽ�ⳣ��K�����H=_____________________(�á�H1�͡�H2��ʾ)��K=____________________________________(��K1��K2��ʾ)���������������֪����ӦCO2(g) + H2(g) ![]() CO(g) + H2O(g)��___________________��Ӧ(����ȡ����ȡ�)��
CO(g) + H2O(g)��___________________��Ӧ(����ȡ����ȡ�)��
��2��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬������ӦFe(s)+CO2(g) ![]() FeO(s)+CO(g) ��H ��0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
FeO(s)+CO(g) ��H ��0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��

�ٸ������·�Ӧ��ƽ�ⳣ��Ϊ________________________________________��
�����д�ʩ����ʹƽ��ʱc(CO)/c(CO2)�������______________________________________(�����)��
A.�����¶� B.����ѹǿ
C.����һ������CO2 D.�ټ���һ��������
��һ���¶��£���һ���̶��ݻ����ܱ������з���������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����________________________________(����ĸ)��
a.������ѹǿ���� b.������ܶȲ��ٸı� c.����(CO2)= ����(CO)
d.c(CO2)= c(CO) e.���������������ʵ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com