
 下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )| X | Y | Z | |
| A | SO2 | CO | CaCl2 |
| B | NH3 | CO2 | Al2(SO4)3 |
| C | NO2 | SO2 | BaCl2 |
| D | Cl2 | O2 | Na2S |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Al(OH)3加入NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 向偏铝酸钠溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸水性 | B. | 脱水性 | C. | 强氧化性 | D. | 酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
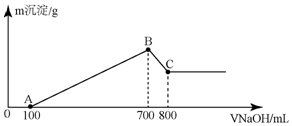 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊变红色的溶液:Fe2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Mg2+、Cl-、Al3+ | |
| C. | 0.1mol•L-1Na2SO3溶液:K+、SO42-、ClO- | |
| D. | 0.1mol•L-1NaAlO2溶液:Na+、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
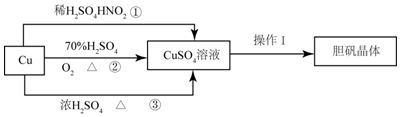
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁、纯碱、冰水混合物 | B. | 氢气、陶瓷、漂白粉 | ||
| C. | 液氧、烧碱、碘酒 | D. | 金刚石、二氧化碳、漂粉精 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com