
| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的总能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
分析 根据放热反应中反应物总能量大于生成物总能量,等量的物质完全燃烧时放出的热量大于不完全燃烧时的热量,据此来解答.
解答 解:A.2C+O2=2CO是放热反应,12gC与16gO2所具有的总能量一定高于28gCO所具有的能量,故A正确;
B.因2CO+O2═2CO2是放热反应,所以56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量,但无法确定56gCO所具有的能量与88gCO2所具有的总能量的大小,故B错误;
C.因2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2都是放热反应,所以C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2也是放热反应,所以12gC和32O2所具有的总能量一定高于44gCO2所具有的总能量,故C正确;
D.因物质完全燃烧放出的热量比不完全燃烧放出热量多,所以一定质量的碳燃烧,生成CO2比生成CO时放出的热量多,故D正确.
故选B.
点评 本题考查了放热反应,解此类题要明确,反应物能量是指所有反应物的总能量和,生成物能量是指所有生成物总能量和,而不是某一个反应物和某一个生成物能量进行对比,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | C60和Ar | C. | NaCl和HCl | D. | CaO和CsCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的稳定性逐渐减弱 | |
| B. | A、B、C、D只能形成5种单质 | |
| C. | X、Y、Z三种化合物的熔、沸点逐渐降低 | |
| D. | 由A、B、C、D四种元素既能组成共价化合物又能组成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>d | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子半径X2+<W3+ | D. | 第一电离能X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中NH4+、S2-、Fe3+、K+可以大量共存 | |
| B. | 与NaHCO3溶液的反应为Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 通入过量的氨气,最终看不到沉淀 | |
| D. | 与Ba(OH)2反应使SO42-沉淀完全的离子方程式为2Al3++6OH-+3SO42-+3Ba2+═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
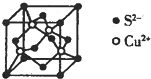 硫及其化合物具有广泛的用途.回答下列问题:
硫及其化合物具有广泛的用途.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com