
下列实验操作对应的图象不正确的是 ( )
选项 | A | B | C | D |
实验操作 | 向MgCl2、AlCl3溶液中(各1 mol),逐滴加入NaOH溶液 | 向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1 mol),逐滴加入NaOH溶液 | 向NaOH、NaAlO2溶液中(各1 mol),逐滴加入HCl溶液 | 向NaOH、Na2CO3混合溶液中(各1 mol)滴加稀盐酸 |
图象 |
|
|
|
|
科目:高中化学 来源:2017届湖北省枣阳市高三上学期8月调研化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.自然界中所有金属都以化合态形式存在
B.化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低
C.废旧金属处理的最好办法是深埋
D.冶炼金属的一般步骤是:浮选富集→冶炼→精炼
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期摸底考试化学试卷(解析版) 题型:选择题
等物质的量的Na和Al两种金属加入足量的水中,生成26.88L(标准状况下)的气体,则下列描述错误的是( )
A.金属 Al无剩余 B.c (Na+)=c(AlO2-)
C.所得溶液呈碱性 D.Na的物质的量是0.6mol
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期摸底考试化学试卷(解析版) 题型:选择题
将24g可能含Na、Mg、Al、Fe的合金投入稀HCl中放出氢气的质量为2g,则此合金中一定含( )
A、Na B、Mg C、Al D、Fe
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列关于铁的说法正确的是( )
A.纯铁为灰黑色,所以铁属于黑色金属
B.铁在硫蒸气中燃烧生成Fe2S3
C.纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化
D.铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期摸底考试化学试卷(解析版) 题型:选择题
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c (SO42—)=0.8 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市增城区四校高三第一次联考理综化学试卷(解析版) 题型:实验题
焦亚硫酸钠(化学式为:Na2S2O5):白色粉末,水溶液显酸性,受潮易分解,遇强酸则放出一种刺激性气味的气体。它是一种化工原料,常用作抗氧化剂。
工业上,常用湿法制作焦亚硫酸钠,湿法制作有三步,其中:
第一步:在饱和碳酸钠溶液中通入足量的SO2,调至PH=4.1,得亚硫酸氢钠;
第二步:……
第三步:……
根据上述内容,回答问题:
(1)焦亚硫酸钠中S的化合价为
(2)第一步化学方程式为:
(3)焦亚硫酸钠含量测定:取焦亚硫酸钠样品约0.15g ,于密封瓶中,加入0.05mol/L碘(I2)滴定液50ml,塞紧,振摇溶解后,加盐酸1ml,用0.1mol/L硫代硫酸钠(Na2S2O3)滴定液滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,用去硫代硫酸钠溶液VmL。并将滴定结果进行空白对比。
已知:每1ml碘滴定液(0.05mol/L)相当于4.750mg的Na2S2O5。
该反应有两个离子方程式,分别为:
a: 3H2O + S2O52- + 2I2 = 2SO42- + 4I- + 6H+
b: 5H2O + S2O32- + 4I2 = 2SO42- + 8I- + 10H+
①a反应中每消耗1mol还原剂转移 mol电子;
②滴定至终点时的判定方法是: ;
③焦亚硫酸钠的质量分数为(列式表示,不计算结果): (可能用到的相对分子质量:Na2S2O5=190)
④由于碘单质在水中溶解度低,因此碘滴定液通常用I2与KI混溶得到碘(KI3)滴定液。取12.7g碘单质和26.6g碘化钾加水50mL溶解后,加盐酸3滴,定容至1000mL。该碘(KI3)滴定液物质的量浓度为 ;该碘(KI3)滴定液与焦亚硫酸钠反应时具有 性(填“氧化”或“还原”)。[可能用到的相对原子质量:I=127、K=39]
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第一次月考化学试卷(解析版) 题型:填空题
氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NC13) 。氯胺消毒时首先发生水解,生成具有强烈杀菌作用的次氯酸。
(2) NH2Cl中氯元素的化合价为_______,其电子式为________。
(2) NH2Cl水解的离子方程式为____________。
(3)三氯胺在常温下为黄色黏稠的油状液体,有毒,在弱酸性溶液中稳定性较好。将0.01mol NCl3通入100mL0.5mol/LNa2SO3溶液中,转移电子的物质的量为___________。
(4)已知:
2NH3(g)+ 3Cl2(g)=N2(g)+ 6HCl(g) △H1=-469kJ·mol-1
N2(g)+ 3Cl2(g)=2NC13(g) △H2=+520kJ·mol-1
NH3(g)+3Cl2(g)=NC13(g)+3HCl(g) △H3
则△H3=_________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省葫芦岛市六校协作体高三上期初考试化学试卷(解析版) 题型:填空题
工业上可用以下方案使饮用水中NO3-含量达标。
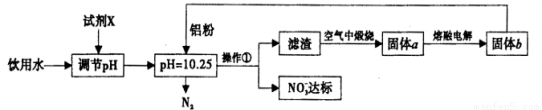
请回答下列问题:
(1)调节pH不宜过大或过小,否则会造成 的利用率降低;试剂X可选用________(填序号)。
A. NaOH B.Ca(OH)2
C.NH3.H2O D.CuO
E.CO2
(2)流程中操作①的名称为 。
(3)写出溶液中铝粉和NO3-反应的离子方程式:____________。
(4)还可用以下化学反应使饮用水中NO3-含量达标,产物之一是空气的主要成分。完成下列离子方程式:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com