
| A. | 紫外线 | B. | 福尔马林 | C. | 硫酸钠 | D. | 浓盐酸 |
分析 蛋白质变性是指蛋白质在某些物理和化学因素作用下其特定的空间构象被改变,从而导致其理化性质的改变和生物活性的丧失,这种现象称为蛋白质变性.
能使蛋白质变性的化学方法有加强酸、强碱、尿素、乙醇、丙酮、甲醛等有机溶剂化学物质、重金属盐等;
能使蛋白质变性的物理方法有加热(高温)、紫外线及X射线照射、超声波、剧烈振荡或搅拌等.
解答 解:A.紫外线能用于杀菌消毒,故能使蛋白质变性,故A错误;
B.福尔马林能使蛋白质变性,故B错误;
C.硫酸钠是非重金属盐,不能使蛋白质变性,故C正确;
D.浓盐酸是强酸能使蛋白质变性,故D错误.
故选C.
点评 本题考查蛋白质的变性,难度不大,了解蛋白质变性的常用方法,注意蛋白质变性是不可逆的.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
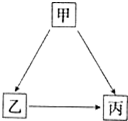 甲、乙、丙三种物质有如图所示的转化关系.
甲、乙、丙三种物质有如图所示的转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
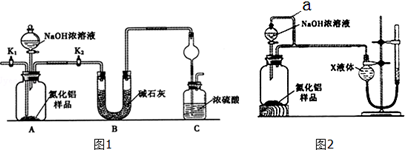

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
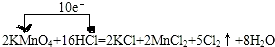 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
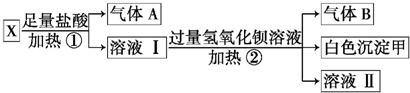
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
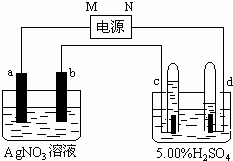 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
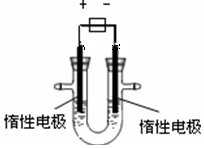
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
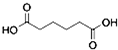 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图: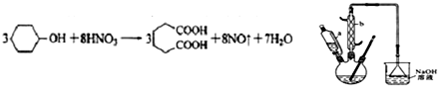
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com