
2KMnO4+16HCl=2MnCl2+5Cl2↑+8H2O+2KCl,在这个反应中,氧化剂是 ,氧化产物是 ,用双线桥标出电子的转移方向和数目 。
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:填空题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O
当反应中有2.408×1024个电子发生转移时,还原剂的质量为
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)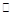 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | x | 2.0 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2.0 | 1.0 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(l)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。

Ⅰ.测定过氧化氢的含量
(1)取10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250mL,移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,写出滴定过程中发生反应的离子方程式: _____________________________________________________
(2)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
Ⅱ.探究过氧化氢的性质
(1)H2O2与铜的有关探究实验:将铜丝置于用硫酸酸化的H2O2溶液中,铜被迅速氧化,溶液变蓝;同时产生大量气体,经检测该气体能使余烬木条复燃,反应的离子方程式为:_________________________。
②将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是__________,写出产生气体这一现象的反应的化学方程式__________________________。
(2)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现,这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,ClO-与H2O2反应的离子方程式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
KClO3+ HCl(浓)= KCl+ ClO2+ Cl2+ H2O
(1)配平以上化学方程式(化学计量数填入划线上)并用双线桥标出电子转移的方向和数目。
(2)反应中的氧化剂是 , ClO2是反应的 (填氧化或还原)产物。
(3)反应产生0.1 mol Cl2,则转移的电子的物质的量为 mol。
(4)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位物质的量得到电子数表示)是Cl2的 倍。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是 。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式: 。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是:
①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是 。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是 (填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被__________ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:
①步骤1中反应的离子方程式是_______________。
②步骤2所加的氧化剂最适宜的是____________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为__________
[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是__________(写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是_______________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。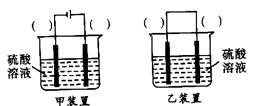
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。并写出电极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.现有八种微粒:Na、Mg2+、Fe2+、Fe3+、S2-、SO2、HCl、H2O,从元素化合价的角度分析,其中只有氧化性的是______ ,只有还原性的是_____ _,
既有氧化性又有还原性的是__________ _。
Ⅱ.已知能用氯酸钾与浓盐酸反应制取氯气,其化学方程式如下:
KClO3+6HCl=KCl+3Cl2↑+ 3H2O
⑴用单线桥在上述方程式中标出电子转移的方向和数目。
⑵标况下生成3.36LCl2,转移电子的物质的量为 ,被氧化的盐酸与未被氧化的盐酸质量之比为 。氧化产物与还原产物物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知33As、35Br位于同一周期。某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式是 。
(2)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(3)该反应的氧化剂和还原剂的物质的量之比为__________; KBrO3与HBr反应也会生成X,则该反应中氧化剂和还原剂的物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com