
【题目】研究硫元素及其化合物的性质具有重要意义。
I.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_________;装置III中溶液逐渐褪色,证明二氧化硫具有___________性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
A.硫化钠溶液 B.氨水 C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(填序号)。
a.KSCN溶液和氯水 b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为____________。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体,产生CO2的理由是_______________(用化学方程式表示)
【答案】(1)使SO3凝结成固体与SO2分离(1分);还原性(2分)
(2)2SO2+3NaOH=Na2SO3 +NaHSO3+H2O(2分)
(3)ABD(3分) (4)c(2分)
(5)57.1%(2分)(6)C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
【解析】
试题分析:(1)二氧化硫和氧气反应生成三氧化硫,三氧化硫的熔点较低,所以可以用冰水浴冷凝使SO3凝结成固体与SO2分离;二氧化硫使酸性高锰酸钾溶液褪色表现了二氧化硫的还原性。
(2)氢氧化钠的物质的量为3.0×0.04=0.12mol,吸收二氧化硫的质量为5.12克,即5.12÷64=0.08 mol,所以二氧化硫和氢氧化钠按0.0.8:0.12=2:3反应生成亚硫酸钠和亚硫酸氢钠,方程式为2SO2+3NaOH=Na2SO3 +NaHSO3+H2O。
(3)二氧化硫和氯化钡不反应,但加入硫化钠,亚硫酸根离子和硫离子可以反应生成硫沉淀,加入氨水和二氧化硫反应生成亚硫酸铵,亚硫酸铵和氯化钡反应生成亚硫酸钡沉淀。加入盐酸不反应,加入硝酸钾,酸性条件下,硝酸根离子和二氧化硫反应生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,所以选ABD。
(4)a、因为有铁离子,加入硫氰化钾显红色,不能再检验亚铁离子,错误。B、加入氢氧化钠溶液,铁离子反应生成氢氧化铁红褐色沉淀,而氢氧化亚铁的白色观察不明显,错误。C、酸性高锰酸钾和亚铁离子反应,溶液的紫色退去,能检验亚铁离子,正确;D、铁离子和铁反应生成亚铁离子,不能检验原来是否存在亚铁离子,错误。所以选c。
(5)二氧化硫和过氧化氢反应生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,4.66克硫酸钡的物质的量为4.66÷233=0.02mol,则二氧化硫为0.02mol,体积为0.02×22.4=448毫升,体积分数=448 ÷784=57.1%。
(6)因为铁质材料中含有碳,碳能和浓硫酸在加热条件下反应生成二氧化碳,方程式为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1,下列说法不正确的是
A.CO(g)+![]() O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B.2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为 。

(2)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“硫二两,硝二两,马兜铃三钱半。右为末,拌匀”。这段中国古代炼丹家对“伏火方”的记载被认为是黑火药配方的雏形。下列对后来发展成熟的黑火药配方中主要成分的说法正确的是
A. 硫酸、硝石、木炭粉 B. 硫磺、芒硝、马兜铃粉
C. 硫磺、销石、木炭粉 D. 硫磺、硝酸、马铃薯粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物。某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水。

(1)红热的炭与浓硫酸发生反应的实验装置如图,仪器a的名称为________,在使用前需要检漏,检漏的方法是_________。
(2)能证明红热的炭与浓硫酸反应产物中有CO2的实验现象为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知NA是阿伏加徳罗常数,下列说法正确的是( )
A. 7.lg氯气与足量的氢氧化钠溶液反应转移的电子数为0.2NA
B. V L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
C. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0NA
D. 工业用电解法进行粗铜精炼时,毎转移lmol电子,阳极上溶解的铜原子数必为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 地沟油经过加工处理可用来制肥皂
B. NH3的水溶液可以导电,说明NH3是电解质
C. 糖类、油脂、蛋白质均为高分子化合物
D. 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,其在电解质储罐和电池间不断循环。下列说法不正确的是
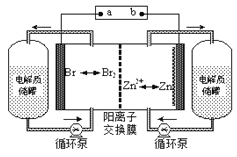
A.放电时负极的电极反应式为Zn-2e-=Zn2+
B.充电时电极a为电源的负极
C.阳离子交换膜可阻止Br2与Zn直接发生反应
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.将等质量的锌片和铜片用导线相连并插入500 mL CuSO4溶液中构成如图所示的装置。
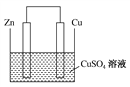
(1)该装置为________装置,该装置中发生反应的离子方程式为______________,铜片周围溶液会出现________的现象。
(2)若锌2 min后的质量减少1.3 g,则导线中流过的电子为________mol。
(3)若将该装置的电解质溶液换为FeCl3溶液,其正极反应为____________________。
Ⅱ.向2 L的密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应xA(g)+yB(g) pC(g)+qD(g)。已知:平均反应速率v(C)=![]() v(A);反应至2 min时,A的物质的量减少了
v(A);反应至2 min时,A的物质的量减少了![]() ,B的浓度减少了
,B的浓度减少了![]() a mol·L-1,同时有a mol D生成。
a mol·L-1,同时有a mol D生成。
(1)0~2 min内,v(A)=________。
(2)该化学方程式中,y=________。
(3)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较,反应速率_______(填“增大”、“减小”或“不变”),理由是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com