

| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| 1.0mol/L |
| 1.0mol/L |
| c(CO) |
| c(CO2) |
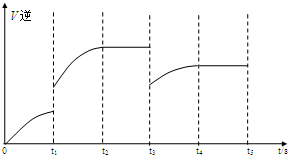 ,
, .
.


科目:高中化学 来源: 题型:
| A、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
| B、将过量SO2通入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ |
| C、向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-═NH3↑+H2O |
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁和铝 | B、铁和铝 |
| C、镁和钠 | D、铁和铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNH3中含有的电子数为10NA | ||
| B、1molCl2与足量Fe反应,转移的电子数为3 NA | ||
| C、标准状况下,22.4 L氩气含氩原子数为2NA | ||
D、在1 L 0.1 mol?L-1的NH4Cl溶液中,NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g乙烯和28g丙烯中均含有6NA对共用电子对 |
| B、在熔融状态下,1mol NaHSO4完全电离出的阳离子数为2NA |
| C、7.8g Na2O2含有的阴离子数目为0.2NA |
| D、分别处于第二、三周期的两种元素的原子各1 mol,其最外层电子数最多相差8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com