
【题目】按要求回答下列问题
(1)质子数为17、中子数为20的原子可表示为________,Na+的结构示意图________。
(2)焰色反应是_______变化,将碳酸钠进行焰色反应,火焰呈________。
(3)漂白粉有效成分的化学式________,漂白粉发挥漂白作用的反应方程式________。
【答案】![]()
![]() 物理 黄色 Ca(ClO)2 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
物理 黄色 Ca(ClO)2 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
【解析】
(1)根据原子符号中各个角标的含义书写;Na+是Na原子失去最外层的1个电子后形成的;
(2)焰色反应是原子核外电子发生能量跃迁时的结果,Na元素焰色反应呈黄色;
(3)漂白粉是氯气与石灰乳反应产生,其有效成分是次氯酸钙,漂白时次氯酸钙与CO2、H2O反应产生HClO。
(1)在原子表示中,在元素符号左下角为质子数,左上角为质量数,等于质子数与中子数的和,该原子质子数为17,是Cl元素的原子,中子数为20,则其质量数为17+20=37,该原子可表示为![]() ;Na是11号元素,Na原子失去最外层的1个电子形成Na+,其结构示意图为:
;Na是11号元素,Na原子失去最外层的1个电子形成Na+,其结构示意图为:![]() ;
;
(2)当金属或其化合物灼烧时,电子由能量较低的基态跃迁到能量较高的激发态,电子处于激发态时,不稳定,多余的能量以光的形式释放出来,因此在发生焰色反应是时没有新物质生成,发生的是物理变化;将碳酸钠进行焰色反应,由于含有Na元素,所以火焰呈黄色;
(3)漂白粉是氯气与石灰乳反应产生,其成分是CaCl2、Ca(ClO)2,有效成分是次氯酸钙,漂白粉发挥漂白作用时,其中含有的次氯酸钙与CO2、H2O反应产生HClO,反应方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,它性能稳定,供应充足,铝—空气电池具有能量密度高、工作原理简单、成本低、无污染等优点。铝—空气电池工作原理示意图如图:
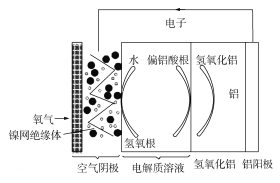
下列说法错误的是
A. 若是碱性电解质溶液中,则电池反应的离子方程式为:4Al+3O2+6H2O+4OH=4Al(OH)4-
B. 若是中性电解质溶液中,则电池反应的方程式为:4Al+3O2+6H2O=4Al(OH)3
C. 如果铝电极纯度不高,在碱性电解质溶液中会产生氢气
D. 若用该电池电解氯化钠溶液(石墨作电极),当负极减少5.4g时,阳极产生6.72L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是

A. a点时,已经滴入NaOH溶液
B. b点所示的溶液中,只存在两种分子
C. a、b、c、d四个点中,c点水的电离程度最大
D. d点所示的溶液中,钠元素与氯元素的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小。向一定浓度的![]() 溶液中滴入某浓度的
溶液中滴入某浓度的![]() 溶液,其电导率随滴入的
溶液,其电导率随滴入的![]() 溶液体积的变化如图所示。下列说法不正确的是( )
溶液体积的变化如图所示。下列说法不正确的是( )
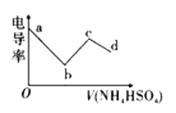
A. bc段的离子方程式为:![]()
B. c点溶液中:![]()
C. bc段之间存在某点,其溶液中:![]()
D. b点溶液存在三个平衡,且水的电离被抑制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的有( )
①需要通电才可以进行的有:电解、电离、电镀、电泳②水玻璃、福尔马林、天然橡胶、铝热剂都是混合物③![]() 、
、![]() 、
、![]() 均可由化合反应制得④油脂、淀粉、纤维素、天然橡胶都是天然有机高分子化合物⑤“血液透析”和“静电除尘”利用了胶体的同一种性质⑥
均可由化合反应制得④油脂、淀粉、纤维素、天然橡胶都是天然有机高分子化合物⑤“血液透析”和“静电除尘”利用了胶体的同一种性质⑥![]() 、
、![]() 分子中的碳原子均共面⑦铅蓄电池放电结束后,正极电极板的质量在减小
分子中的碳原子均共面⑦铅蓄电池放电结束后,正极电极板的质量在减小
A. 2个B. 3个C. 4个D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是第ⅠA~ⅦA族的三种非金属元素,它们在元素周期表中的位置如图所示,试回答下列问题。
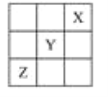
(1)X元素单质的化学式是________。
(2)Y元素的原子结构示意图是____________,Y与Na所形成化合物的电子式为________________________。
(3)Z元素的名称是________,从元素原子得失电子的角度看,Z元素具有________性;若从Z元素在元素周期表中所处位置看,它具有这种性质的原因是_________________________,其价电子排布式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:已知亚磷酸![]() 是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
(1)亚磷酸与银离子反应的离子方程式为_______________________。
(2)向亚磷酸溶液中滴加氢氧化钠溶液至中性,写出所得溶液中电荷守恒方程式_________________。
(3)某温度下,![]() 的亚磷酸溶液的pH为1.4,即
的亚磷酸溶液的pH为1.4,即![]() ,则该温度下亚磷酸的一级电离平衡常数
,则该温度下亚磷酸的一级电离平衡常数![]() _________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
_________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
Ⅱ:焦亚硫酸钠![]() 在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
(5)由于![]() 具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中
具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中![]() 的残留量时,取40mL葡萄酒样品,用
的残留量时,取40mL葡萄酒样品,用![]() 的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中
的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中![]() 的残留量为___________
的残留量为___________ ![]() (以
(以![]() 计)。
计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 与
与![]() 反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得
反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得![]() ;③打开K,通入
;③打开K,通入![]() 直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出
直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出![]() ;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
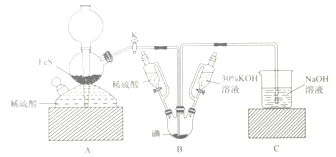
A. 步骤②可观察到固体溶解,溶液由棕黄色变为无色
B. 步骤③装置B中发生反应的离子方程式为![]()
C. 装置C中氢氧化钠溶液的作用是吸收硫化氢
D. 步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含5.00×10-3mol·L-1的![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料![]() (
(![]() 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
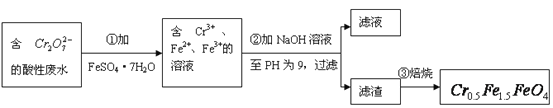
(1)第①步反应的离子方程式是_________________________________________________;
(2)第②步中用pH试纸测定溶液pH的操作是:
______________________________________________________________________________;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有______________________;
(4)欲使1L该废水中的![]() 完全转化为
完全转化为![]() 。理论上需要加入__________g FeSO4·7H2O。
。理论上需要加入__________g FeSO4·7H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com