
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向C试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 假设3成立 |
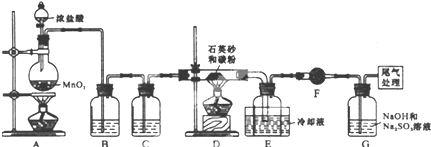
分析 制备四氯化硅的实验流程:A中发生二氧化锰与浓盐酸的反应生成氯气,MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯,最后G处理含氯气的尾气,
(1)装置C中的试剂应该吸收水而不能吸收氯气,用浓硫酸干燥氯气;四氯化硅遇水极易水解,F可防止空气中的水进入;
(2)二氧化锰和浓盐酸发生氧化还原反应生成氯化锰、氯气和水;A装置中,有一处明显错误是圆底烧瓶加热缺少石棉网;
(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液(或溴水)褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3.
解答 解:制备四氯化硅的实验流程:A中发生二氧化锰与浓盐酸的反应生成氯气,MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯,最后G处理含氯气的尾气,
(1)浓盐酸具有挥发性,加热促进挥发,导致制取的氯气中含有氯化氢,为除去氯化氢,装置B中的试剂应该吸收氯化氢而不能吸收氯气,为饱和食盐水,装置C用浓硫酸吸水,四氯化硅遇水极易水解,F可防止右端的水蒸气进入E与四氯化硅反应,造成产物不纯,
故答案为:浓硫酸;防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯;
(2)装置A是氯气发生装置,A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,其离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,圆底烧瓶底部表面积比较大,需用石棉网确保底部受热均匀,所以A装置中,有一处明显错误是圆底烧瓶加热缺少石棉网,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;无石棉网;
(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO,
故答案为:SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,
故答案为:①0.01mol/L的KMnO4(或溴水);②品红;③淀粉-KI;若溶液变为蓝色.
点评 本题考查制备实验方案的设计,题目难度中等,涉及氯气的制法、硅的提纯等实验知识,明确制备原理及实验流程中的反应、物质的性质等为解答的关键,试题侧重分析与实验能力的综合考查,培养了学生的分析、理解能力及化学实验能力.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B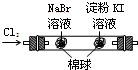 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D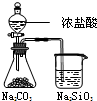 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| C. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| D. | 工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 在H2SO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
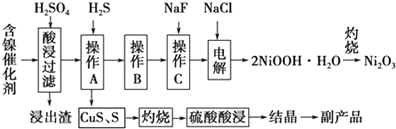
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
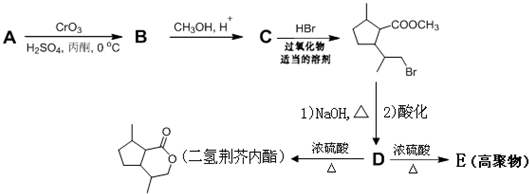
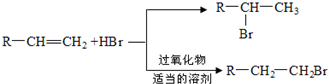
 ,D中含有的官能团的名称羧基、羟基.
,D中含有的官能团的名称羧基、羟基.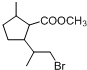 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$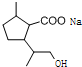 +CH3OH+NaBr.
+CH3OH+NaBr.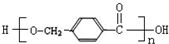 )的路线补全完整
)的路线补全完整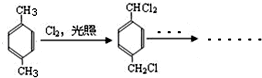
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3(MnO2,加热) | B. | KMnO4(加热) | C. | H2O2(MnO2) | D. | HgO(加热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com