
【题目】已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中正确的是
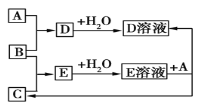
A. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B. A、B、C中有一种金属且为B
C. 如果E溶液是一种强酸,则E溶液为硫酸
D. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究NO和Na2O2的反应,设计了如下图所示实验装置,其中E为实验前压瘪的气囊。
资料:除浅黄色的AgNO2难溶于水外,其余亚硝酸盐均易溶于水。
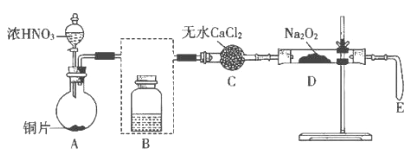
(1)写出A中反应的化学方程式:____________________________。
(2)将装置B补充完整,并标明试剂_____________。
(3)用无水CaCl2除去水蒸气的目的是_____________________________。
(4)反应一段时间后,D处有烫手的感觉,其中固体由淡黄色变为白色,直至颜色不再变化时,气囊E始终没有明显鼓起。
①学生依据反应现象和氧化还原反应规律推断固体产物为NaNO2。写出该反应的化学方程式:_________________________________。
②设计实验证明的NaNO2生成,实验方案是___________________________。(写出操作、现象和结论)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)
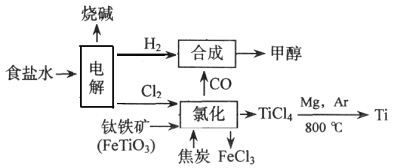
下列叙述正确的是
A. 该流程中只有“电解”、“氯化”涉及氧化还原反应
B. “氯化”时每消耗36g焦炭,则转移7mol电子
C. “合成”反应中氧化剂与还原剂的物质的量之比为1:1
D. 上述流程中“Mg,Ar"可用“Mg,CO2”代替
查看答案和解析>>
科目:高中化学 来源: 题型:
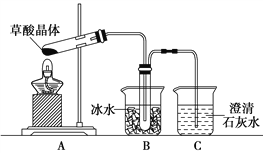
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
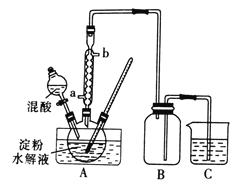
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%HSO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为__________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6+___HNO3 ![]() ___H2C2O4+9NO2↑+3NO↑+ ______
___H2C2O4+9NO2↑+3NO↑+ ______
(3)称取mg草酸晶体粗产品,配成100mL溶液。取20.00mL于锥形瓶中,用amoL·L-1KMnO4标准液标定,只发生
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择下述装置验证产物CO2,装置B的主要作用是__________。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
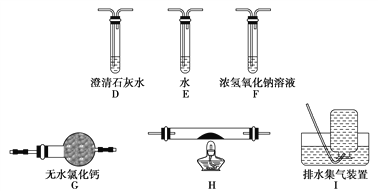
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用下面图象表示的是( )
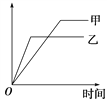
反应 | 纵坐标 | 甲 | 乙 | |
A | SO2与O2在同温、同体积容器中反应 | SO2的转化率 | 2 mol SO2和 1 mol O2 | 2 mol SO2和 2 mol O2 |
B | 一定质量的氮气和氢气,在同一固定容积的容器中反应 | 氨气的浓度 | 400 ℃ | 500 ℃ |
C | 2 mol SO2与1 mol O2在同温、体积可变的恒压容器中反应 | SO2的转化率 | 1×106 Pa | 1×105 Pa |
D | 体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
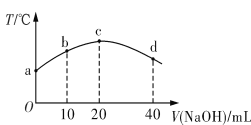
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g) ![]() CH3OH(g)的反应热△H4=________________。
CH3OH(g)的反应热△H4=________________。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) ![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
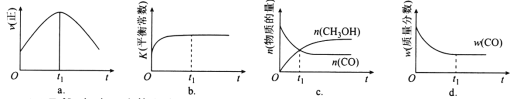
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=_______________________。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______5 L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=____________________________。
CH3OH(g)的平衡常数K=____________________________。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_________________________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
B. 常温下,224 mL H2O中所含氢氧键的数目约为0.02NA
C. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
D. 常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com