盐酸在中学化学占有重要的地位,实验室有一未知浓度的盐酸溶液.
(1)为了测定该盐酸的浓度,取2.0mL该盐酸加水稀释后用0.10mol?L
-1NaOH标准溶液滴定.实验数据如下:
| 实验编号 | 1 | 2 | 3 |
| 滴入NaOH溶液的体积(mL) | 21.90 | 19.95 | 20.05 |
①第1组实验的数据不合理,造成这种误差的原因可能是
(填字母).
A.碱式滴定管用清水洗净后未经标准液润洗
B.滴定前仰视读数,滴定终了俯视读数
C.锥形瓶未用待测液润洗
②计算该盐酸物质的量浓度为
mol?L
-1(数据精确到0.01).
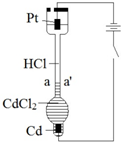
(2)某实验小组设计如下装置探究盐酸溶液中阴、阳离子在电场中的迁移情况:
常温下,在垂直的玻璃细管内,先放入CdCl
2溶液及显色剂,然后小心放入盐酸溶液,在aa'处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法不正确的是
.
A.通电时,H
+、Cd
2+向Pt电极迁移,Cl
-向Cd电极迁移
B.装置中总反应的化学方程式为:Cd+2HCl
CdCl
2+H
2↑
C.如果电源正负极反接,则下端产生大量Cl
2,界面不再清晰,实验失败
(3)上述实验中Cd
2+会污染环境,实验结束后要对溶液进行处理:在实验后的溶液中投入石灰,使镉离子变为难溶的Cd(OH)
2沉淀.(已知Cd(OH)
2的Ksp=5×10
-15)
①若实验后溶液中c(Cd
2+)=0.005mol?L
-1,要生成Cd(OH)
2沉淀,应调整溶液的酸碱性,使之pH大于
.
②若向Cd(OH)
2饱和溶液中加入少量NaOH固体,Cd(OH)
2的质量将
(填“增大”“减小”“不变”),原因是
.
③也可将Cd(OH)
2转化成更难溶的CdS除去:Cd(OH)
2(s)+S
2-(aq)=CdS(s)+2OH
-(aq),已知298K时,Ksp(CdS)=8×10
-27,求此温度下该反应的平衡常数K=
.

 盐酸在中学化学占有重要的地位,实验室有一未知浓度的盐酸溶液.
盐酸在中学化学占有重要的地位,实验室有一未知浓度的盐酸溶液.

 阅读快车系列答案
阅读快车系列答案 原子序数小于36的A、B、C、D、E五种元素,其原子序数依次增大,B原子基态时2p原子轨道上有3个电子,C原子基态时最外层电子数是电子层数的3倍,化合物AC2为非极性分子;化合物DC为离子晶体,D的+2价阳离子比C的阴离子多一个电子层.E的原子序数为24.
原子序数小于36的A、B、C、D、E五种元素,其原子序数依次增大,B原子基态时2p原子轨道上有3个电子,C原子基态时最外层电子数是电子层数的3倍,化合物AC2为非极性分子;化合物DC为离子晶体,D的+2价阳离子比C的阴离子多一个电子层.E的原子序数为24.