
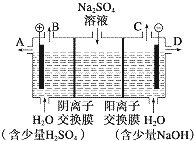
 某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.分析 (1)该电解槽的阳极上水失电子生成氧气和氢离子;阴离子交换膜的离子是氢氧根离子、通过阳离子交换膜的离子是钠离子,根据电荷守恒判断;
(2)阳极上是氢氧根离子失电子产生氧气,生成的酸在阳极附近生成;
(3)甲醇燃料电池的负极上是燃料发生失电子的氧化反应,据此回答.
解答 解:(1)电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,故答案为:4OH--4e-=2H2O+O2↑;小于;
(2)阳极上是氢氧根离子失电子产生氧气,生成的酸在阳极附近生成;故答案为:A;
(3)甲醇燃料电池的负极上是燃料发生失电子的氧化反应,即CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查了原电池和电解池原理,为高频考点,注意装置的判断及燃料原电池电极反应式和电解反应的书写,把握电解质溶液的酸碱性确定生成的离子或物质,题目难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该有机物仅含碳、氧两种元素 | |
| B. | 该有机物中碳、氧、氧原子个数比为1:4:2 | |
| C. | 无法确定是否含有氧元素 | |
| D. | 该有机物中一定含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、2mol CO2 | 4mol FeO、3mol CO |
| CO的浓度(mol•L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 | |
| B. | 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 | |
| C. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| D. | 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
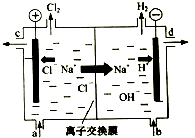 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
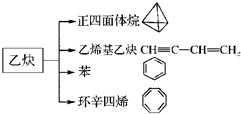 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: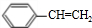 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$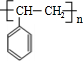
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯在强碱性环境下水解:CH3CO18OC2H5+OH-$\stackrel{△}{→}$ CH3COO -+C2H518OH | |
| B. | 苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O $\stackrel{△}{→}$ C6H5OH+CO32- | |
| C. | 醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2═Cu2++2CH3COO-+2H2O | |
| D. | 溴乙烷在氢氧化钠水溶液中的反应:CH3CH2Br+OH-$\stackrel{△}{→}$CH3CH2OH+Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com