
某校研究性学习小组同学在实验时把SO2通入装有1mol/LBaCl2溶液的试管中,出现了白色浑浊物。
(1)实验小组的同学根据沉淀溶解平衡原理查阅了工具书上的相关数据,经过计算推导得出:常温下即使把SO2通入1mol/L BaCl2溶液中至饱和,也不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4。你认为所查阅的数据为: 。
(2)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:
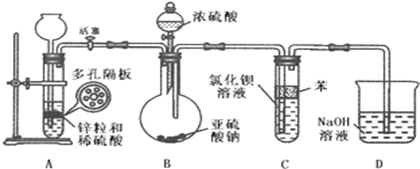
①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过 全【品教学网, 用后离不了!注入稀硫酸.打开活塞,将产生的氢气导入到后续装置.
②D中气泡均匀冒出并验纯全【品教学网, 用后离不了!后关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的 全【品教学网, 用后离不了!滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题
(2)实验步骤①和③的空白处使用的仪器名称分别为 、 全【品教学网, 用后离不了!;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,其作用是: 。
(4)装置C中苯的作用是 。
(5)装置D的目的是 全【品教学网, 用后离不了!
(6)写出实验步骤⑤试管中发生反应的化学方程式 、 全【品教学网, 用后离不了!;
【知识点】二氧化硫的制备、性质及实验探究
【答案解析】(16分)(1)SO2饱和溶液中各离子的浓度、(SO2的溶解度、亚硫酸的电离平衡常数)以及 BaSO3的溶度积常数(BaSO3的溶解度或Ksp(BaSO3)全【品教学网, 用后离不了!)。(2分)(2)长颈漏斗全【品教学网, 用后离不了!、 分液漏斗(2分)(3)赶出装置中的空气防止H2SO3被氧化(2分)(4)将BaCl2溶液与空气隔离,防止H2SO3被氧化全【品教学网, 用后离不了!;(2分)(5)除去SO2防止污染空气(2分)(6)SO2+H2O2=H2SO4、(或H2SO3+H2O2=H2SO4+H2O) H2SO4+BaCl2=BaSO4↓+2HCl全【品教学网, 用后离不了!;(4分)
解析:(1)能够生成BaSO3沉淀,需要查阅SO2饱和溶液中各离子的浓度。(2)可以通过长颈漏斗实现锌粒和酸的接触,分液漏斗的结构和长颈漏斗有很大异,分液漏斗有盖有旋塞,长颈漏斗都没有。(3)A装置获取氢气的作用是赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响。(4)苯密度比水小,在氯化钡溶液的上层,可以起到隔离空气的作用。(5)二氧化硫有毒,为了防止造成污染,在实验结束时要再次打开活塞,将产生的氢气导入后续装置一段时间,让SO2全部被氢氧化钠吸收以防止污染。(6)双氧水具有氧化性,可以将二氧化硫氧化为硫酸,进而和氯化钡反应生成沉淀,发生的化学反应为:SO2+H2O2=H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl。
【思路点拨】本题综合考查二氧化硫的制备、性质及实验探究,具有一定的综合性,能够比较全面考查考生基础知识和基本技能。难度较大,区分度较好。


科目:高中化学 来源: 题型:
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)  2C(g),
2C(g),
2 min后达到平衡,生成0.4 mol C,测得混合气体共3.4 mol,则下列结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作不正确的是
A.吸滤完毕停止吸滤时,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关闭水龙头全【品教学网, 用后离不了!
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
已知:锌元素与铝元素相似,具有两性。
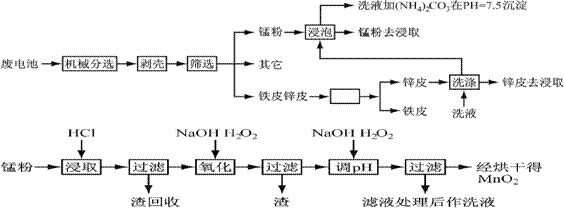
1、市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为 ;
电极总反应方程为 ;
2、在预处理中,分离铁皮和锌皮的方法是 ,洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质的化学式为 。
3、二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ;盐酸溶解后回收的渣是 ;
4、已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是 ;
5、实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为
;
6、硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据实验目的判断下列实验操作或装置正确的是
| 目的 | A.检验火柴头燃烧 产生的SO2 | B.配制稀硫酸 溶液 | C.分离Cl2与KBr 反应生成的Br2 | D.检查装置 气密性 |
| 装置 或 操作 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
减压吸滤装置和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是
A.可过滤胶状沉淀 B.可过滤颗粒更小的沉淀
C.可得到较干燥的沉淀 D.可使沉淀中的杂质减少
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II. 将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV. TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。
|

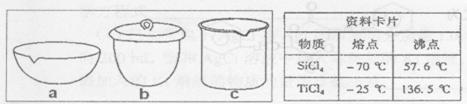
②如实验IV中,应将TiO2.xH2O放在_______ (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的 等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为P g/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
| |
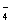 + H2O2+ H+= Mn2++ H2O+
+ H2O2+ H+= Mn2++ H2O+ ②滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________。
③重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________ (填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中发生反应:2X(g)+Y(g)aZ(g) ΔH=Q kJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
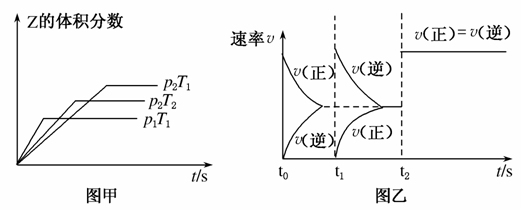
A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com