
(14分)碳酸锶广泛应用于电子工业。以天青石(主要成分为SrSO4)为基本原料制备碳酸锶。
(1)碳还原法制备。
①已知:SrSO4(s) + 4C(s)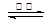 4CO(g) + SrS(s) △H=+a kJ·mol-1
4CO(g) + SrS(s) △H=+a kJ·mol-1
SrSO4(s) + 2C(s)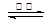 2CO2(g) + SrS(s) △H=+b kJ·mol-1
2CO2(g) + SrS(s) △H=+b kJ·mol-1
则:反应C(s) + CO2(g)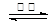 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。
②SrS是强碱弱酸盐,热水中发生水解的化学反应方程式为_______________________。
③水解所得Sr(OH) 2与NH4HCO3按照物质的量比1:1投料制备SrCO3,则化学反应方程式为__________________________________________________。
(2)湿法制备。(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10。)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为: ____________。
②当转化完成时,混合液中c(CO32-)= 1.0×10-3mol/L,c(SO42-)=______________mol/L。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| 高温 |
| (a-b) |
| 2 |
| (a-b) |
| 2 |
 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-| O | 2- 3 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)碳酸锶广泛应用于电子工业。以天青石(主要成分为SrSO4)为基本原料制备碳酸锶。
(1)碳还原法制备。
①已知:SrSO4(s) + 4C(s)![]() 4CO(g) + SrS(s) △H = +akJ·mol-1
4CO(g) + SrS(s) △H = +akJ·mol-1
SrSO4(s)+ 2C(s)![]() 2CO2(g) + SrS(s) △H=+bkJ·mol-1
2CO2(g) + SrS(s) △H=+bkJ·mol-1
则:反应C(s) +CO2(g)![]() 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。
②SrS是强碱弱酸盐,热水中发生水解的化学反应方程式为_______________________。
③水解所得Sr(OH) 2与NH4HCO3按照物质的量比1:1投料制备SrCO3,则化学反应方程式为__________________________________________________。
(2)湿法制备。(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10。)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为: ____________。
②当转化完成时,混合液中c(CO32-)= 1.0×10-3mol/L,c(SO42-)=______________mol/L。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:填空题
(14分)碳酸锶广泛应用于电子工业。以天青石(主要成分为SrSO4)为基本原料制备碳酸锶。
(1)碳还原法制备。
①已知:SrSO4(s) + 4C(s)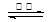 4CO(g) + SrS(s) △H = +a
kJ·mol-1
4CO(g) + SrS(s) △H = +a
kJ·mol-1
SrSO4(s)
+ 2C(s)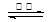 2CO2(g) + SrS(s) △H=+b
kJ·mol-1
2CO2(g) + SrS(s) △H=+b
kJ·mol-1
则:反应C(s) +
CO2(g)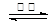 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。
②SrS是强碱弱酸盐,热水中发生水解的化学反应方程式为_______________________。
③水解所得Sr(OH) 2与NH4HCO3按照物质的量比1:1投料制备SrCO3,则化学反应方程式为__________________________________________________。
(2)湿法制备。(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10。)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为: ____________。
②当转化完成时,混合液中c(CO32-)= 1.0×10-3mol/L,c(SO42-)=______________mol/L。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省扬州市邗江区蒋王中学高三(上)期中化学模拟试卷(解析版) 题型:解答题
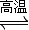 4CO(g)+SrS(s);△H=+akJ?mol-1
4CO(g)+SrS(s);△H=+akJ?mol-1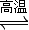 2CO2(g)+SrS(s);△H=+bkJ?mol-1
2CO2(g)+SrS(s);△H=+bkJ?mol-1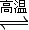 2CO(g)的△H=______kJ?mol-1.
2CO(g)的△H=______kJ?mol-1.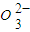 )=1.0×10-3mol/L,c(S
)=1.0×10-3mol/L,c(S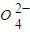 )=______mol/L.
)=______mol/L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com