
 已知 25℃时部分弱电解质的电离平衡常数数据如表:
已知 25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | Ka1=4.3×10-1Ka2=5.6×10-1 | 3.0×10-8 |
分析 (1)碳酸是二元弱酸,分步电离,第一步电离会抑制第二步电离,将碳酸溶液加水稀释,溶液酸性减弱,但促进碳酸的电离,据此分析;
(2)据弱酸的电离平衡常数,判断弱酸的酸性强弱,越弱越水解,电离程度越大,溶液pH越大,据此分析;
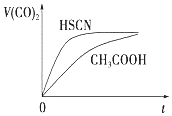
(3)由生成二氧化碳的曲线斜率可知HSCN反应较快,则可知HSCN中中c(H+)较大,说明HSCN酸性较强,再利用盐类水解的规律来分析离子浓度的关系;
(4)根据溶液中的电荷守恒和物料守恒来计算;
(5)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸.
解答 解:(1)碳酸的主要的电离方程式为H2CO3?H++HCO3-,碳酸溶液加水稀释,促进碳酸的电离,稀释后的溶液中 c(H+) 大于原来的十分之一,
故答案为:H2CO3?H++HCO3-;大于;
(2)据弱酸的电离平衡常数可知,酸性HSCN>CH3COOH>H2CO3>HCN>HCO3-,酸性越弱,其酸根离子的水解程度越大,溶液pH越大,所以等物质的量浓度的a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 e.NaSCN溶液的pH由小到大的顺序为e<a<d<c<b,故答案为:e<a<d<c<b;
(3)由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)<c(SCN-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
(4)CH3COOH与CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L,
故答案为:10-6-10-8;
(5)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,
故答案为:ClO-+CO2+H2O═HClO+HCO3-.
点评 本题考查了盐类水解、弱酸的电离平衡常数与酸性强弱的关系、弱酸的电离平衡的移动,注意越弱越水解,题目难度不大.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 | B. | 1 | C. | 0.25 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个N2分子和NA个CO分子质量比为1:2 | |
| B. | 1 mol H2O的质量等于NA个H2O质量的总和 | |
| C. | 在任何条件下1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数 | |
| C. | 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深 | |
| D. | 容器Ⅰ中 H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3水解生成的 Fe(OH)3胶粒数为 lNA | |
| B. | 将 lmol Cl2通人水中,HC1O、Cl、C1O 粒子数之和为 2NA | |
| C. | 1 mol Fe 溶于过量硝酸,电子转移数为 2NA | |
| D. | 10℃时,lL pH=1.0 的 H2SO4溶液中含 H+为 0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氖元素的相对原子质量是a | |
| B. | 该氖原子的摩尔质量是aNAg | |
| C. | Wg该氖原子的物质的量一定是$\frac{W}{{a{N_A}}}$mol | |
| D. | Wg该氖气的体积是22.4$\frac{W}{{a{N_A}}}$升 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com