
| A�� | x=1 | |
| B�� | B��ת����Ϊ80% | |
| C�� | 2min��A��ƽ����Ӧ����Ϊ0.3 mol•��L•min��-1 | |
| D�� | �����������ܶȲ��䣬Ҳ�������÷�Ӧ�ﵽƽ��״̬ |
���� 2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D��D��Ũ��Ϊ$\frac{0.8mol}{2L}$=0.4mol/L�������C��Ũ��Ϊ0.2mol•L-1����֪$\frac{0.4}{0.2}$=$\frac{2}{x}$�����x=1����
3A��g��+B��g��?C��g��+2D��g��
��ʼ 1.5 0.5 0 0
ת�� 0.6 0.2 0.2 0.4
ƽ�� 0.9 0.3 0.2 0.4
���ת����=$\frac{ת������}{��ʼ����}$��100%��v=$\frac{��c}{��t}$���ܶ�ʼ�ղ��������
��� �⣺2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D��D��Ũ��Ϊ$\frac{0.8mol}{2L}$=0.4mol/L�������C��Ũ��Ϊ0.2mol•L-1����֪$\frac{0.4}{0.2}$=$\frac{2}{x}$�����x=1����
3A��g��+B��g��?C��g��+2D��g��
��ʼ 1.5 0.5 0 0
ת�� 0.6 0.2 0.2 0.4
ƽ�� 0.9 0.3 0.2 0.4
A��������������֪x=1����A��ȷ��
B��B��ת����Ϊ$\frac{0.2}{0.5}$��100%=40%����B����
C.2min��A��ƽ����Ӧ����Ϊ$\frac{0.6mol/L}{2min}$=0.3 mol•��L•min��-1����C��ȷ��
D����������������������䣬���ܶ�ʼ�ղ��䣬�����������ܶȲ��䣬Ҳ�������÷�Ӧ�ﵽƽ��״̬����D��ȷ��
��ѡB��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ջ�ѧƽ�����η���ת���ʼ����ʼ���Ϊ���Ĺؼ������ط�������������Ŀ��飬ע��x��ȷ������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢܢݢޢߢ� | B�� | �ڢݢޢߢ� | C�� | �ڢܢݢޢߢ� | D�� | �ۢܢݢޢߢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molNa2O2������������̼��Ӧת�Ƶĵ�����Ϊ2 NA | |
| B�� | ��״����22.4L CCl4������ԭ����Ϊ5NA | |
| C�� | 56g Fe���κ�������ȫ��Ӧʱת�Ƶĵ�����һ��Ϊ2NA | |
| D�� | 1molþ����������������Ӧ��ʧȥ2NA�ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A������ | �۵�/K | B������ | �۵�/K |
| NaCl | 1 074 | Na | 317 |
| KCl | 1 049 | Mg | 923 |
| CsCl | 918 | Al | 933 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
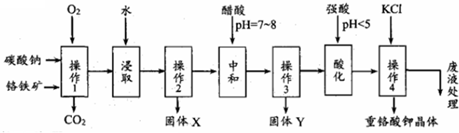
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ԭ�����������Ϊ1.2V | B�� | ԭ�����������Ϊ1.1V | ||
| C�� | ��Ӧ��ƽ��ʱ����B���ĵ�0.05V | D�� | ��Ӧ�ﵽƽ��ʱ����A���ĵ�0.05V |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
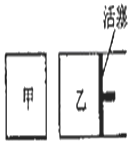 ���ݻ���ͬ�ļס������������У���ͼ��ʾ�����ֱ����2molSO2��2molO2��ʹ��������ͬ�¶��·�����Ӧ2SO2��g��+O2��g��?2S03��g�����ﵽƽ�⣮�ڷ�Ӧ�����У������������ݻ����䣬��������ѹǿ���䣬����S02��ת����Ϊb%����������SO2��ת����Ϊa%����a��b�Ĺ�ϵΪ��������
���ݻ���ͬ�ļס������������У���ͼ��ʾ�����ֱ����2molSO2��2molO2��ʹ��������ͬ�¶��·�����Ӧ2SO2��g��+O2��g��?2S03��g�����ﵽƽ�⣮�ڷ�Ӧ�����У������������ݻ����䣬��������ѹǿ���䣬����S02��ת����Ϊb%����������SO2��ת����Ϊa%����a��b�Ĺ�ϵΪ��������| A�� | ��ȷ�� | B�� | a��b | C�� | a=b | D�� | a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�淋ĵ���ʽ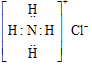 | B�� | �����ĵ���ʽ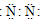 | ||
| C�� | ������ĽṹʽH-Cl-O | D�� | �Ȼ��Ƶĵ���ʽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com