
| A、NaCl |
| B、BaSO4 |
| C、Al2O3 |
| D、HNO3 |
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
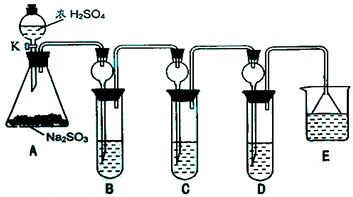 某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.
某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤、洗涤干净备用. | / |
| 用另一干净试管取少量沉淀样品,加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
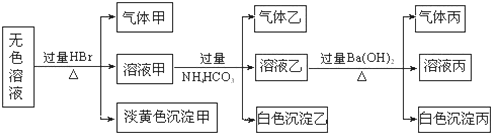
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、19.56% | B、20% |
| C、22% | D、25% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com