
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。请完成下列填空:
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是_______。
(2)氧化镁的电子式为_______,CO2的结构式为______。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为______,其1个原子中能量最高的电子有______个。
(3)一定条件下,在容积恒为2.0L的容器中,Fe和CO2发生如下反应:CO2(g)+Fe(s)![]() FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
(4)下列说法错误的是_______。
a.当混合气体的密度不变时说明反应达到了平衡
b.混合气体的平均相对分子质量不变时说明反应达到了平衡
c.平衡后移除二氧化碳时,正反应速率一直减小直至建立新的平衡
d.平衡后缩小容器的体积,正逆反应速率不变,平衡不移动
(5)保持温度不变的情况下,待反应达到平衡后再充入一定量的二氧化碳,平衡向______移动(选填“正向”、“逆向”、或“不”),二氧化碳的转化率_____(填“增大”,“减小”或“不变”)。
【答案】金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的分子间作用力,故金刚石的熔点远高于足球烯 ![]() O=C=O 3s23p1 1 1:3 0.075mol/(L·min) c、d 正向 不变
O=C=O 3s23p1 1 1:3 0.075mol/(L·min) c、d 正向 不变
【解析】
(1)金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力;
(2)氧化镁的电子式为![]() ;CO2中碳和氧共用四对电子,所以结构式是O=C=O;第三周期元素中,离子电子层数越少,核电荷数越大,其离子半径越小,所以离子半径最小的是Al3+;
;CO2中碳和氧共用四对电子,所以结构式是O=C=O;第三周期元素中,离子电子层数越少,核电荷数越大,其离子半径越小,所以离子半径最小的是Al3+;
(3)CO2(g)+Fe(s) ![]() FeO(s)+CO(g)是气体体积不变的反应,5.0min后,容器内气体是总物质的量为1mol的CO和CO2混合气体,设CO的物质的量为xmol,CO2的物质的量为(1-x)mol,相对平均分子量为
FeO(s)+CO(g)是气体体积不变的反应,5.0min后,容器内气体是总物质的量为1mol的CO和CO2混合气体,设CO的物质的量为xmol,CO2的物质的量为(1-x)mol,相对平均分子量为![]() =32g/mol,以此解答;
=32g/mol,以此解答;
(4)根据反应到达平衡的特征回答;
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动,但到达新平衡时的效果与原平衡等效,故二氧化碳的转化率不变。
(1)金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力,故熔点金刚石大于石墨烯;
(2)氧化镁的电子式为![]() ;CO2中碳和氧共用四对电子,所以结构式是O=C=O;第三周期元素中,离子电子层数越少,核电荷数越大,其离子半径越小,所以离子半径最小的是Al3+,Al原子核外最外层电子数是3且位于第三电子层上,所以Al原子价电子排布式为3s23p1;在含多个电子的原子中,能量最高的电子是离原子核最远的电子,Al原子中能量最高的电子有1个;
;CO2中碳和氧共用四对电子,所以结构式是O=C=O;第三周期元素中,离子电子层数越少,核电荷数越大,其离子半径越小,所以离子半径最小的是Al3+,Al原子核外最外层电子数是3且位于第三电子层上,所以Al原子价电子排布式为3s23p1;在含多个电子的原子中,能量最高的电子是离原子核最远的电子,Al原子中能量最高的电子有1个;
(3)CO2(g)+Fe(s) ![]() FeO(s)+CO(g)是气体体积不变的反应,5.0min后,容器内气体是总物质的量为1mol的CO和CO2混合气体,设CO的物质的量为xmol,CO2的物质的量为(1-x)mol,相对平均分子量为
FeO(s)+CO(g)是气体体积不变的反应,5.0min后,容器内气体是总物质的量为1mol的CO和CO2混合气体,设CO的物质的量为xmol,CO2的物质的量为(1-x)mol,相对平均分子量为![]() =32g/mol,解得x=0.75,则CO的物质的量为0.75mol,CO2的物质的量为0.25mol,n(CO2):n(CO)之比为1:3;这段时间内用CO2表示的速率v(CO2)=
=32g/mol,解得x=0.75,则CO的物质的量为0.75mol,CO2的物质的量为0.25mol,n(CO2):n(CO)之比为1:3;这段时间内用CO2表示的速率v(CO2)= 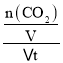 =
=  =0.075mol/(L·min);
=0.075mol/(L·min);
(4)a. CO2(g)+Fe(s) ![]() FeO(s)+CO(g)是气体体积不变的反应,当混合气体的密度不变时说明,混合气体的质量不变,说明应该达到平衡,正确;
FeO(s)+CO(g)是气体体积不变的反应,当混合气体的密度不变时说明,混合气体的质量不变,说明应该达到平衡,正确;
b. CO2(g)+Fe(s) ![]() FeO(s)+CO(g)是气体总物质的量不变的反应,混合气体的平均相对分子质量不变时,混合气体的质量不变,说明应该达到平衡,正确;
FeO(s)+CO(g)是气体总物质的量不变的反应,混合气体的平均相对分子质量不变时,混合气体的质量不变,说明应该达到平衡,正确;
c. 平衡后移除二氧化碳时,正反应速率先减小后增大,直至建立新的平衡,故错误;
d.平衡后缩小容器的体积,正逆反应速率增大,但平衡不移动,故错误;
错误的是c、d;
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动,但到达新平衡时的效果与原平衡等效,故二氧化碳的转化率不变;


科目:高中化学 来源: 题型:
【题目】人们认识最早的盐是食盐,![]() 尚书
尚书![]() 说命
说命![]() 记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对
记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对![]() 、
、![]() 、
、![]() 、
、![]() 四种常见的盐进行探究。回答下列问题:
四种常见的盐进行探究。回答下列问题:
⑴已知![]() 时,AgCl的溶度积为
时,AgCl的溶度积为![]() ,则AgCl在
,则AgCl在![]() 溶液中的
溶液中的![]() 为________
为________![]() 。
。
⑵![]() 时,
时,![]() 溶液的
溶液的![]() ,则关于该溶液中
,则关于该溶液中![]() 的说法正确的是________。
的说法正确的是________。
A.与m无关的定值 ![]() 与m有关的定值
与m有关的定值 ![]() 与
与![]() 有关的不定值
有关的不定值
⑶![]() 时,将
时,将![]() 溶液和
溶液和![]() 溶液各
溶液各![]() 混合,此时混合溶液的
混合,此时混合溶液的![]() ,则
,则![]() 的电离平衡常数
的电离平衡常数![]() ________
________![]() 用含n的表达式表示
用含n的表达式表示![]() 。
。
⑷将![]() 、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜
、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜![]() ,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为
,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为![]() ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到![]() 固体。所得数据显示
固体。所得数据显示![]() ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中![]() ________。
________。
⑸![]() 时,向
时,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的盐酸
的盐酸![]() ,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量
,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量![]() 纵轴
纵轴![]() 也发生变化,如图所示:
也发生变化,如图所示:
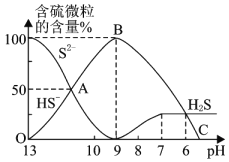
![]() 反应到A点时,溶液中的离子浓度大小的关系为________。
反应到A点时,溶液中的离子浓度大小的关系为________。
![]() 点对应的溶液中大量存在的溶质是________。
点对应的溶液中大量存在的溶质是________。
![]() 混合溶液的
混合溶液的![]() ________时,溶液中开始有
________时,溶液中开始有![]() 气体放出。
气体放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量___(填“高”或“低”)。
②N2(g)+O2(g)═2NO(g)的△H=___。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)2CO2(g)+N2(g)△H=akJmol﹣1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值___(选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1。如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)═CO2(g)+3H2(g)的△H1___(选填“>”“=”或“<”)0
②图中途径(Ⅱ)的条件是___,途径(Ⅰ)的反应热___(选填“>”“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H2
H2(g)+![]() O2(g)═H2O(g)△H3
O2(g)═H2O(g)△H3
△H1、△H2、△H3三者的关系式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.35Cl2与37Cl2互称同位素
B.白磷和红磷互为同素异形体
C.戊烷共有三种同分异构体,其沸点各不相同
D.(CH3)3CCH=CHCH3与H2加成反应后的产物名称是2,2-二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中可能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO![]()
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Cu2+、Mg2+、NO![]() 、SO
、SO![]()
C.0.1mol·L-1FeCl3溶液中:Fe2+、NH![]() 、SCN-、SO
、SCN-、SO![]()
D.无色溶液中:Cu2+、Al3+、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成。
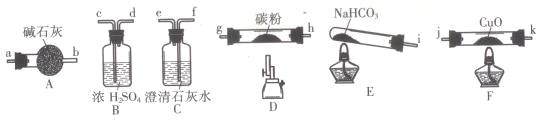
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:
i→______________________________________尾气处理(填仪器接口的字母编号)。
(2)说明CO能还原CuO的实验现象为___________________________。
(3)该实验处理尾气的方法为___________________________。
(4)若去掉B装置,可能产生的影响为___________________________。
(5)将各装置按正确的顺序连接后进行实验。当反应结束后,F处硬质玻璃管中的固体全部变为红色。
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+。
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③________。
[实验验证]该小组为验证上述猜想,分别取少量红色固体放入试管中,进行如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量稀硝酸,振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
b | 加入足量稀硫酸,振荡 | 试管内有红色固体,溶液为无色 |
[实验评价]根据上述实验,不能确定红色固体成分的实验是________(填实验编号),理由为_________(用化学方程式表示)。
[实验结论]根据上述实验结果,可知红色固体的成分为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素化合物的化学用语不正确的是
A.氟离子的结构示意图:![]()
B.H和Cl形成共价键的过程:![]()
C.铅蓄电池放电时的负极反应:Pb(s)+SO42-(aq)-2e-=PbSO4(s)
D.![]() 氧化
氧化![]() 生成单质硫:
生成单质硫:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是
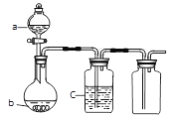
编号 | 气体 | a | b | c |
A | SO2 | 浓H2SO4 | 铜屑 | 饱和Na2SO3溶液 |
B | CO2 | 稀HNO3 | 碳酸钙 | 饱和NaHCO3 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com