
| A、③ | B、①②③④ |
| C、⑤⑥ | D、②③⑥ |


科目:高中化学 来源: 题型:
| A、11.2 L N2与14 g CO气体所含有的原子数 |
| B、电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| C、6.2 g Na2O和7.8 g Na2O2中所含的离子数 |
| D、1.8g重水(D2O,D为12H)中含有的中子数为6.02×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、3:2:1 |
| C、6:3:2 |
| D、4:3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgCl2 Na2SO4 BaCl2 KOH |
| B、BaCl2 AgNO3 CaCl2 HNO3 |
| C、NaOH Na2SO4 KNO3 HCl |
| D、HCl Na2CO3 Na2SO4 BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8a kJ |
| B、a kJ |
| C、2a kJ |
| D、0.9a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11g | B、5.5g |
| C、2.5g | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
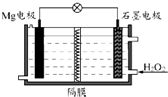 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图所示.该电池工作时,下列说法错误的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图所示.该电池工作时,下列说法错误的是( )| A、Mg电极是该电池的负极 |
| B、溶液中Cl-向石墨电极移动 |
| C、该装置中电子从Mg电极流向石墨电极 |
| D、H2O2在石墨电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、υ正=υ逆≠0时的状态 |
| B、NO2全部转变成N2O4的状态 |
| C、c(NO2)=c(N2O4)的状态 |
| D、N2O4不再分解的状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com