
【题目】利用下图所示装置从海水中提取CO2,有利于减少环境中温室气体的含量。下列说法正确的是

A. 通电后,a室的pH增大
B. 中间隔室发生的反应:HCO3-+H+==CO2↑+H2O,从而提取CO2
C. 阴极反应式为2H+-2e-==H2↑
D. 当电路中通过1mol电子的电量时,会有22.4LCO2气体产生
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.己知某些化学键的键能数据如下:
化学键 | C=O | C-O | C-H | H-H | O-H |
键能/kJ·mol-1 | a | b | c | d | e |
(1)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
II.将燃煤废气中的CO 转化为二甲醚的反应原理为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如下图所示:

①该反应的△H_____0(填“>”或“<”)。
②700K,将4molH2和2molCO2投入2L恒容密闭容器中,反应经3min达到平衡,则CH3OCH3(g)在0~3min内的生成速率为_________。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是_______。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0molCO26.0molH2 | 0.10mol | 0.04mol | 0.02mol |
II.1.0molCH3OCH33.0molH2O | X1 | Y1 | Z1 |
①P3______P2(填“>”、“<”或“”);
②P2下,I中CH3OCH3的平衡转化率为_______。
III.在一定条件下,CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(5)在1L密闭容器中若CO2(g)、H2(g)初始投料均为1mol,反应达平衡时CO在平衡混合气中的体积分数为25%,则该温度下该反应的平衡常数K=____。向此容器中再充入CO2(g)、H2(g)各0.5mol,则平衡_______(填“正向移动”、“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国“9.11”恐怖袭击事件中,毁坏的建筑物发出大量石棉,人吸入石棉纤维易患肺癌。石棉是硅酸盐矿物,某种石棉的化学式为:CaMgxAlySi3O12,该化学式中x、y的值分别是( )
A.2、2B.2、3C.3、2D.4、3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸法是在一定温度下盐酸与铝土矿、高岭土或粉煤灰等固体中的活性Al2O3发生反应制备Al2O3的工艺。氯化铝溶液可通过蒸发结晶生成结晶氯化铝,进而焙烧得到氧化铝;也可利用氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低的特点,生成氯化铝晶体,从而焙烧得到氧化铝。图1是我国某公司研发的具有自主知识产权的“一步酸溶法”工艺流程。
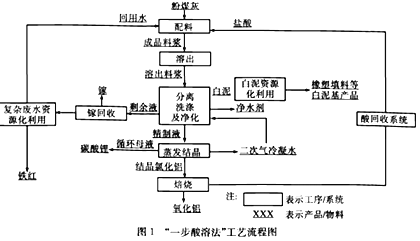
回答下列问题:
(1)“氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低”的原因是________________________________________________________(结合必要的化学方程式说明)。
(2)精制液蒸发结晶后分离出纯净结晶氯化铝的操作名称是_______,用_____洗涤。
(3)写出结晶氯化铝(AlCl3·6H2O)焙烧的化学方程式:_____________________________。
(4)工业上冶炼金属铝的方法是电解熔融的_______(填化学式),电解过程中作阳极的石墨易消耗,原因是___________________________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 146 C 和 146 C 是不同种核素,化学性质也不相同
B. H2O 和H2O2 互为同素异形体
C. CH3COOCH2CH3 和 CH3CH2COOCH3 互为同系物
D. CH3CH(CH3)2 的名称叫 2-甲基丙烷,也可以叫做异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废钡渣(主要成分为BaS2O3,含少量SiO2)为原料生产高纯氟化钡的流程如下:
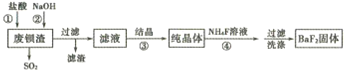
已知:Kap(BaS2O3)=6.96×10-11,Kap(BaF2)=1.0×10-6
(1)步骤①除产生SO2外,还有淡黄色固体生成,该反应的离子方程式为______________。
(2)步骤②的目的是中和过量的盐酸,加入NaOH溶液不宜过量,其原因是__________(用离子方程式表示)。
(3)滤液的主要成分是BaCl2,还含有少量NaCl,溶解度数据如下表:
温度 | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
NaCl | 36.0g | 36.6g | 37.3g | 39.0g | 39.8g |
BaCl2 | 35.8g | 40.8g | 46.2g | 52.5g | 59.4g |
步骤③宜采用_____ (填“蒸发结晶”或“降温结晶”)。
(4)工业上可用氨水吸收SO2,并通入空气使其转化为铵态氮肥。该转化中氧化剂与还原剂的物质的量之比为__________。
(5)步骤④生成BaF2的反应类型为____________。
①若该反应温度过高,容易造成c(F-)降低的原因是__________。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度,将浓度为0. 1mol·L-1的BaCl2溶液和0.22 mol·L-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=__________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com